فهرست عناوین
- مقدمه ای بر اهمیت شناخت ویژگی های خاص اسید نیتریک
- ساختار شیمیایی منحصر به فرد اسید نیتریک
- قدرت اکسیدکنندگی بالای اسید نیتریک
- واکنش پذیری ویژه اسید نیتریک با فلزات
- خاصیت ناپایداری اسید نیتریک در برابر نور و گرما
- تولید نیتروژن دی اکسید (NO₂) به عنوان نشانه ای از ویژگی خاص اسید نیتریک
- قدرت تخریب فوق العاده اسید نیتریک
- تفاوت رفتار اسید نیتریک رقیق و غلیظ
- تشکیل مخلوط های انفجاری با مواد آلی
- پدیده نیتره کردن توسط اسید نیتریک
- ویژگی چند منظوره اسید نیتریک در صنایع مختلف
- حساسیت اسید نیتریک به حضور ناخالصی ها
- ترکیب اسید نیتریک با اسید سولفوریک برای ساخت نیترو ترکیبات
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 11-02-1404
تاریخ بروزرسانی مقاله : 11-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
ویژگی های خاص اسید نیتریک

مقدمه ای بر اهمیت شناخت ویژگی های خاص اسید نیتریک
اسید نیتریک ترکیب شیمیایی پرکاربردی است که در صنایع گوناگون از تولید کودهای شیمیایی تا ساخت مواد منفجره و پزشکی نقشی حیاتی ایفا می کند. درک عمیق ویژگی های منحصر به فرد این اسید از جمله قدرت اکسیدکنندگی بالا ، خاصیت خورندگی شدید و واکنش پذیری متنوع آن برای استفاده ایمن و کارآمد در هر زمینه ای الزامی است. عدم آشنایی با این ویژگی ها منجر به خطرات جدی برای سلامت انسان ، محیط زیست و بروز حوادث صنعتی می شود. بنابراین آگاهی جامع از رفتار و خواص اسید نیتریک پیش نیاز استفاده صحیح و مسئولانه از این ماده ی شیمیایی قدرتمند است. بررسی دقیق این ویژگی ها ارتقای ایمنی و بهره وری در صنایع مختلف را به دنبال خواهد داشت.
ساختار شیمیایی منحصر به فرد اسید نیتریک
اسید نیتریک با فرمول شیمیایی HNO₃ مولکولی ساده اما با واکنش پذیری شگفت انگیز است. لذا می بایست خواص شیمیایی و فیزیکی اسید نیتریک مورد بررسی قرار گیرد. اتم نیتروژن مرکزی با یک پیوند کووالانسی دوگانه به یک اتم اکسیژن و دو پیوند کووالانسی یگانه به دو اتم اکسیژن دیگر متصل است. یکی از اتم های اکسیژن دارای بار منفی است و اتم هیدروژن به آن متصل شده و از طریق پیوند هیدروژنی با مولکول های دیگر اسید نیتریک یا سایر مولکول های قطبی برهم کنش می دهد. همین ویژگی ها موجب قدرت اسیدی و اکسیدکنندگی بالای آن می شود. پیوند دوگانه N=O الکترونگاتیوی بالای اکسیژن و پیوندهای قطبی در مولکول پتانسیل بالا برای پذیرش الکترون از سایر گونه ها را ایجاد کرده و واکنش های اکسیداسیون-احیا را تسهیل می کنند. این ساختار منشأ رفتار شیمیایی متمایز اسید نیتریک است.
قدرت اکسیدکنندگی بالای اسید نیتریک
قدرت اکسیدکنندگی بی نظیر اسید نیتریک ناشی از ساختار مولکولی آن و حضور اتم نیتروژن در حالت اکسیداسیون +5 است. این اتم تمایل شدیدی به کاهش و پذیرش الکترون دارد. در واکنش های اکسیداسیون ، نیتروژن از حالت +5 به حالت های پایین تر اکسیداسیون مانند +4 (NO2)، +2 (NO) یا حتی 0 (N2) کاهش می یابد. این کاهش در حالت اکسیداسیون انرژی آزاد قابل توجهی را آزاد می کند و نیروی محرکه واکنش های اکسیداسیون را فراهم می کند. این ویژگی اسید نیتریک را به اکسیدکننده ای قدرتمند تبدیل می کند که می تواند طیف وسیعی از مواد را اکسید کند از فلزات تا ترکیبات آلی حتی در غلظت های رقیق. قدرت اکسیدکنندگی آن وابسته به غلظت و دما نیز هست.
واکنش پذیری ویژه اسید نیتریک با فلزات
اسید نیتریک با فلزات واکنش های متنوعی نشان می دهد که به نوع فلز ، غلظت اسید و دما وابسته است. برخلاف سایر اسیدهای معدنی قوی ، اسید نیتریک معمولاً با فلزات واکنش داده و هیدروژن آزاد نمی کند. به جای آن فلزات را اکسید می کند و خود به نیتروژن دی اکسید (NO2) یا نیتریک اکسید (NO) و یا حتی نیتروژن (N2) احیا می شود. برای مثال واکنش با مس منجر به تولید نیتروژن دی اکسید (گاز قهو های سمی) و یون های مس می شود. آلومینیوم و آهن در اسید نیتریک غلیظ و سرد لایه اکسیدی محافظ تشکیل می دهند که از واکنش بیشتر جلوگیری می کند (پاسسیواسیون).
| ردیف | نام فلز | نوع واکنش با اسید نیتریک | گاز متصاعد شده | شدت واکنش | نکات ویژه واکنش |
|---|---|---|---|---|---|
| 1 | مس (Cu) | واکنش شدید | NO₂ (دیاکسید نیتروژن) | بالا | تولید گاز قهوهای، بدون حباب |
| 2 | آهن (Fe) | واکنش متوسط | NO و NO₂ | متوسط | سطح فلز زود خورده میشود |
| 3 | آلومینیوم (Al) | واکنش اولیه و سپس غیرفعال شدن | مقدار کم NO₂ | کم | تشکیل لایه اکسیدی محافظ |
| 4 | روی (Zn) | واکنش سریع | NO و H₂ | بالا | گاززایی شدید، تشکیل نمک نیتریک روی |
| 5 | نقره (Ag) | واکنش آهسته | NO₂ | کم تا متوسط | حمله به سطح فلز، تشکیل رسوب سفید |
| 6 | طلا (Au) | بدون واکنش | - | صفر | اسید نیتریک به تنهایی اثری ندارد |
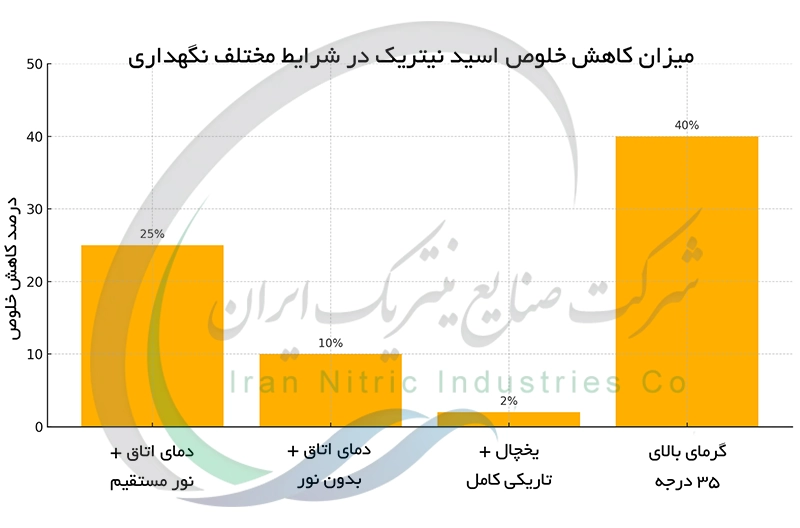
خاصیت ناپایداری اسید نیتریک در برابر نور و گرما
اسید نیتریک ترکیب ناپایداری است که در برابر نور و گرما به آسانی تجزیه می شود. تابش نور خورشید یا افزایش دما مولکول های HNO₃ را به نیتروژن دی اکسید (NO₂)، آب (H₂O)و اکسیژن (O₂) تجزیه می کند. NO₂گازی قهوه ای رنگ و سمی است که نشان دهنده تجزیه اسید است. این تجزیه غلظت اسید را کاهش می دهد و قدرت اکسیدکنندگی آن را تضعیف می کند. نگهداری اسید نیتریک در ظروف تیره و خنک از این تجزیه جلوگیری کرده و طول عمر و کیفیت آن را افزایش می دهد. این موضوع برای خرید اسید نیتریک صادراتی به شدت مهم است. همچنین شدت تجزیه به شدت نور و دمای محیط وابسته است.
تولید نیتروژن دی اکسید (NO₂) به عنوان نشانه ای از ویژگی خاص اسید نیتریک
تولید نیتروژن دی اکسید (NO₂)، گاز قهوه ای رنگ ، نشانه بارز واکنش پذیری بالای اسید نیتریک است. این گاز معمولاً در اثر تجزیه حرارتی یا نوری اسید یا واکنش آن با فلزات خاص تولید می شود. در واکنش با فلزاتی مانند مس ، اسید نیتریک رقیق به نیتریک اکسید (NO) و اسید نیتریک غلیظ به NO₂ تبدیل می شود. NO₂حاصل گازی بسیار سمی و با بوی تند است که موجب آلودگی هوا و خطرات تنفسی می شود. تولید این گاز قهوه ای رنگ به عنوان شاخصی برای تشخیص حضور اسید نیتریک غلیظ و یا اندازه گیری میزان تجزیه آن به کار می رود.
قدرت تخریب فوق العاده اسید نیتریک
اسید نیتریک به دلیل قدرت اکسیدکنندگی بالا و خاصیت اسیدی قوی یکی از خورنده ترین مواد شناخته شده است. این ماده نه تنها فلزات را حل می کند بلکه بر بسیاری از ترکیبات آلی نیز اثر تخریبی شدید دارد. خوردگی شدید اسید نیتریک به توانایی آن در اکسید کردن و تجزیه پیوندهای شیمیایی برمی گردد. برای مقابله با این خاصیت مخرب باید از تجهیزاتی با مقاومت شیمیایی بالا مانند فولاد ضدزنگ ویژه مانند 316L ، تیتانیوم یا برخی پلیمرهای خاص استفاده شود. انتخاب جنس تجهیزات به غلظت اسید ، دما و سایر شرایط عملیاتی وابسته است.
تفاوت رفتار اسید نیتریک رقیق و غلیظ
اسید نیتریک رقیق بیشتر به عنوان یک اسید قوی عمل می کند و با فلزات واکنش داده ، نمک های نیترات و هیدروژن تولید می کند (البته در حضور کاتالیزورهای مناسب). کاربردهای آن در سنتزهای شیمیایی ، تنظیم PH و برخی فرایندهای صنعتی است. در مقابل اسید نیتریک غلیظ عمدتاً به عنوان یک اکسیدکننده قوی عمل می کند. این اسید فلزات را اکسید کرده و خود به ترکیباتی مانند نیتروژن دی اکسید (NO₂) احیا می شود. کاربردهای اسید نیتریک غلیظ شامل تولید مواد منفجره ، حکاکی فلزات و برخی فرآیندهای ویژه در شیمی آلی است. تفاوت در رفتار این دو انتخاب نوع اسید را در هر کاربردی تعیین می کند و رعایت نکات ایمنی در مواجهه با هر دو غلظت ضروری است.
تشکیل مخلوط های انفجاری با مواد آلی
اسید نیتریک به دلیل قدرت اکسیدکنندگی فوق العاده با بسیاری از مواد آلی واکنش های شدیدی می دهد که منجر به تشکیل ترکیبات ناپایدار و بسیار حساس به ضربه یا گرما می شود. این مخلوط ها می توانند به شدت انفجار کنند. مخلوط اسید نیتریک با ترکیباتی مانند سلولز ، روغن ها و یا حتی برخی از حلال ها خطر انفجار ناگهانی را افزایش می دهد. بنابراین مخلوط کردن اسید نیتریک با مواد آلی باید با احتیاط فراوان و رعایت دقیق دستورالعمل های ایمنی انجام گیرد.
پدیده نیتره کردن توسط اسید نیتریک
اسید نیتریک نقش کلیدی در واکنش نیتره کردن ایفا می کند. فرایندی که طی آن گروه نیترو (-NO₂) به یک مولکول آلی افزوده می شود. این واکنش از طریق مکانیسم الکتروفیلی انجام می گیرد که در آن یون نیترونیوم (NO₂⁺) به عنوان الکتروفیل عمل می کند. نیتره کردن ابزاری قدرتمند در سنتز ترکیبات آلی از جمله داروها ، رنگ ها و مواد منفجره است. در صنایع دارویی نیتره کردن برای تولید برخی آنتی بیوتیک ها و داروهای ضد سرطان کاربرد دارد. همچنین نیتره کردن در تولید مواد منفجره مانند تری نیتروتولوئن (TNT) نقش اساسی دارد.
ویژگی چند منظوره اسید نیتریک در صنایع مختلف
در صنعت کودسازی اسید نیتریک برای تولید نیترات آمونیوم یکی از مهم ترین کودهای شیمیایی ازت دار به کار می رود. در صنایع نظامی از اسید نیتریک برای تولید مواد منفجره استفاده می شود. قدرت خورندگی این اسید در تصفیه فلزات و حذف ناخالصی ها از سطح آن ها به کار گرفته می شود. همچنین در تولید برخی از رنگ ها و پوشش های شیمیایی نیز از اسید نیتریک استفاده می شود. به علاوه این اسید در سنتز برخی از داروها و مواد شیمیایی خاص نقش مهمی دارد.
حساسیت اسید نیتریک به حضور ناخالصی ها
ناخالصی ها از جمله فلزات سنگین ، یون های هالید و مواد آلی می توانند واکنش پذیری اسید را تغییر دهند و باعث تجزیه آن شوند. این امر به کاهش قدرت اکسیدکنندگی و افزایش احتمال تشکیل ترکیبات ناپایدار و خطرناک منجر می شود. حضور یون های کلرید به ویژه می تواند واکنش های جانبی ناخواسته را تسریع کند. کنترل کیفیت دقیق و استفاده از اسید با خلوص بالا برای اطمینان از پایداری ، عملکرد و ایمنی در کاربردهای مختلف ضروری است. حتی مقادیر کم ناخالصی ها به طور قابل توجهی بر نتایج واکنش ها و فرآیندهای صنعتی اثر می گذارد.
ترکیب اسید نیتریک با اسید سولفوریک برای ساخت نیترو ترکیبات
ترکیب اسید نیتریک با اسید سولفوریک مخلوطی قدرتمند برای نیتره کردن ترکیبات آلی تشکیل می دهد. اسید سولفوریک به عنوان یک عامل کم آبی عمل کرده و از اسید نیتریک یون نیترونیوم (NO₂⁺) تولید می کند که الکتروفیل بسیار فعالی است که به آسانی به مولکول های آلی حمله می کند. این واکنش در تولید TNT و سایر نیترو ترکیبات مانند نیتروبنزن کاربرد فراوان دارد. کنترل دقیق نسبت دو اسید و دما برای جلوگیری از واکنش های جانبی و حصول بازده مطلوب ضروری است. این فرآیند به دلیل تولید NO₂ گازهای سمی ایجاد می کند و نیاز به سیستم های تهویه قوی دارد.





نقش اسید نیتریک در واکنش های اکسیداسیون
واکنش های گرمازای اسید نیتریک و خطرات مرتبط با آن
خواص خوردگی اسید نیتریک و تأثیر آن بر مواد مختلف