فهرست عناوین
- اسید نیتریک چیست و چرا یک اکسیدکننده قوی محسوب می شود ؟
- مکانیسم عمومی واکنش های اکسیداسیون با اسید نیتریک
- نقش اسید نیتریک در تولید نیترو ترکیبات آلی
- واکنش اسید نیتریک با فلزات : اکسیداسیون و آزاد شدن گاز نیتروژن دی اکسید
- استفاده از اسید نیتریک در استخراج فلزات گرانبها از سنگ معدن
- اکسیداسیون الکل ها با اسید نیتریک : از الکل به کتون یا اسید کربوکسیلیک
- ترکیب اسید نیتریک با اسید سولفوریک : ابر واکنشگر نیتریل کننده و اکسیدکننده
- اکسیداسیون غیرمستقیم با رادیکال های نیتروژن ناشی از اسید نیتریک
- نقش غلظت اسید نیتریک در شدت واکنش های اکسیداسیون
- کاربردهای صنعتی واکنش های اکسیداسیونی با اسید نیتریک
- نقش دما و فشار در کنترل واکنش های اکسیداسیون نیتریکی
- ملاحظات ایمنی هنگام کار با اسید نیتریک در واکنش های اکسیداسیون
- معرفی واکنش های شاخص اکسیداسیون با اسید نیتریک در کتاب های شیمی آلی
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 18-02-1404
تاریخ بروزرسانی مقاله : 18-02-1404
تعداد کلمات : 1400
آدرس مقاله : لینک مقاله
نقش اسید نیتریک در واکنش های اکسیداسیون

اسید نیتریک چیست و چرا یک اکسیدکننده قوی محسوب می شود ؟
اسید نیتریک (HNO₃) یک اسید معدنی قوی و بسیار خورنده با فرمول شیمیایی HNO₃ است. ساختار آن شامل یک اتم نیتروژن متصل به سه اتم اکسیژن و یک گروه هیدروکسیل است. قدرت اکسیدکنندگی بالای آن به دلیل وجود اتم نیتروژن با عدد اکسایش +5 است که تمایل شدیدی به کاهش به عدد اکسایش پایین تر (مانند +4 یا +2) دارد. در این فرآیند اسید نیتریک الکترون از گونه های دیگر دریافت می کند و آن ها را اکسید می کند در حالی که خود به گونه های مختلف مانند دی اکسید نیتروژن (NO₂) یا اکسید نیتریک (NO) کاهش می یابد. این تمایل به گرفتن الکترون اساس قدرت اکسیدکنندگی بالای اسید نیتریک را تشکیل می دهد.
مکانیسم عمومی واکنش های اکسیداسیون با اسید نیتریک
واکنش های اکسیداسیون با اسید نیتریک معمولاً از طریق یک مکانیسم چند مرحله ای انجام می شوند. در مرحله اول اسید نیتریک یک پروتون (H⁺) از دست می دهد و به یون نیترات (NO₃⁻) تبدیل می شود. این یون نیترات یک الکتروفیل قوی است و به راحتی با گونه های آلی یا معدنی واکنش می دهد. در مراحل بعدی انتقال الکترون از ماده اکسیدشونده به یون نیترات انجام می شود. این انتقال الکترون به صورت مستقیم یا از طریق تشکیل گونه های حد واسط انجام می شود. در نهایت ماده اکسیدشونده اکسید شده و اسید نیتریک به گونه های کاهش یافته مانند NO₂ ، NO یا حتی N₂O تبدیل می شود. نوع گونه کاهش یافته اسید نیتریک به شرایط واکنش (مانند غلظت اسید ، دما و ماده اکسیدشونده) بستگی دارد.
| نوع واکنش | عامل اکسیدکننده | ماده هدف | محصول نهایی | شرایط واکنش | نکات ایمنی |
|---|---|---|---|---|---|
| اکسیداسیون فلزات | HNO₃ غلیظ یا رقیق | فلزاتی مانند Cu، Zn | نیترات فلز، گاز NO یا NO₂ | دمای اتاق یا گرمادهی | گاز NO₂ سمی است، تهویه لازم است |
| اکسیداسیون غیرفلزات | HNO₃ غلیظ | کربن، گوگرد، فسفر | CO₂، SO₂، H₃PO₄ | گرما یا شعله | واکنش بسیار شدید و خطر انفجار دارد |
| اکسیداسیون ترکیبات آلی | HNO₃ همراه با H₂SO₄ | الکلها، آلدهیدها | اسیدهای آلی، دیاکسید کربن | دمای کنترلشده (معمولاً زیر ۵۰°C) | خطر واکنش انفجاری با ترکیبات آلی بالا |
| تولید نیترو ترکیبات | HNO₃ + H₂SO₄ (مخلوط نیتره) | آروماتیکها (مانند بنزن) | نیتروبنزن و مشتقات آن | در دمای پایین، همزدن مداوم | خطر انفجار، نیاز به خنککننده |
| تخریب ترکیبات آلی | HNO₃ غلیظ داغ | مواد زیستی یا آلایندهها | CO₂، NO₂، H₂O | شرایط شدید دما و فشار | برای تصفیه زبالههای خطرناک استفاده میشود |
| اکسیداسیون در آزمایشگاه | HNO₃ با کاتالیزور (MnO₂، Fe³⁺) | نمونههای آزمایشگاهی مختلف | محصولات بستگی به ماده دارد | معمولاً در هود شیمیایی انجام میشود | استفاده از دستکش، عینک و ماسک ضروری است |
نقش اسید نیتریک در تولید نیترو ترکیبات آلی
اسید نیتریک نقش اساسی در تولید نیترو ترکیبات آلی به ویژه نیترو آرن ها دارد. در این واکنش ها اسید نیتریک به عنوان یک عامل نیترودار کننده عمل می کند. این واکنش معمولاً در حضور اسید سولفوریک غلیظ (H₂SO₄) انجام می شود. اسید سولفوریک با پروتون دار کردن اسید نیتریک تشکیل یون نیترونیم (NO₂⁺) را تسهیل می کند. یون نیترونیم یک الکتروفیل قوی است که به حلقه آروماتیک حمله می کند و پس از جایگزینی یکی از اتم های هیدروژن حلقه با گروه نیترو (NO₂)، نیترو آرن تولید می شود. این واکنش به عنوان نیتراسیون آروماتیک شناخته می شود و در تولید بسیاری از مواد شیمیایی صنعتی مانند TNT و سایر مواد منفجره و رنگ ها اهمیت فراوانی دارد.
واکنش اسید نیتریک با فلزات : اکسیداسیون و آزاد شدن گاز نیتروژن دی اکسید
اسید نیتریک با بسیاری از فلزات واکنش داده ، آن ها را اکسید می کند. شدت این واکنش به غلظت اسید و نوع فلز بستگی دارد. مس با اسید نیتریک رقیق نیترید مس (I) و اکسید نیتریک تولید می کند در حالی که با اسید غلیظ نیترید مس (II) و دی اکسید نیتروژن تولید می شود. نقره در اسید نیتریک غلیظ حل شده ، نیترات نقره و دی اکسید نیتروژن تولید می کند. فلزات واسطه مانند آهن نیز به طور مشابه اکسید می شوند و نیترات های فلزی و اکسیدهای نیتروژن تولید می کنند. محصولات حاصل به شرایط واکنش بستگی دارند و مخلوطی از نیترات ها و اکسیدهای نیتروژن می باشند.
استفاده از اسید نیتریک در استخراج فلزات گرانبها از سنگ معدن
اسید نیتریک در استخراج فلزات گرانبها به ویژه طلا و نقره از سنگ معدن نقش کلیدی دارد. در فرآیند لیچینگ اسید نیتریک فلزات گرانبها را از ماتریکس سنگ معدن حل می کند. این فرآیند با اکسید کردن فلزات و تشکیل نیترات های محلول انجام می شود. پس از لیچینگ فلزات گرانبها از محلول با روش هایی مانند استخراج با حلال یا رسوب گیری جدا می شوند. اسید نیتریک همچنین در حذف ناخالصی ها و بهبود خلوص فلزات استخراج شده نقش دارد. کنترل دقیق شرایط واکنش برای بهینه سازی استخراج و جلوگیری از اتلاف فلزات گرانبها ضروری است. بخاطر همین کاربردهای مهم ، خرید حواله اسید نیتریک شیراز در طی سال های اخیر رشد چشمگیری پیدا کرده است.
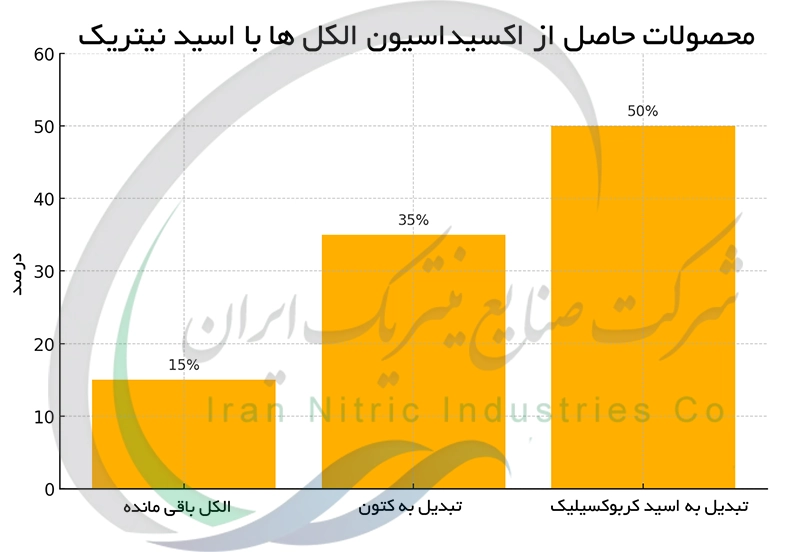
اکسیداسیون الکل ها با اسید نیتریک : از الکل به کتون یا اسید کربوکسیلیک
اکسیداسیون الکل ها با اسید نیتریک یک روش معمول در سنتز آلی برای تبدیل الکل های اولیه به اسیدهای کربوکسیلیک و الکل های ثانویه به کتون ها است. این واکنش ها معمولاً در شرایط کنترل شده و با استفاده از کاتالیزور انجام می شوند تا از واکنش های جانبی جلوگیری شود. اسید نیتریک به عنوان یک اکسیدکننده قوی پیوند C-H را در الکل ها می شکند و گروه هیدروکسیل (OH) را به گروه کربونیل (C=O) یا کربوکسیل (COOH) تبدیل می کند. واکنش های مختلفی مانند اکسیداسیون جونز و اکسیداسیون با اسید نیتریک در حضور کاتالیزورها مانند اکسید وانادیوم (V) وجود دارند که مسیرهای شیمیایی مختلفی را برای اکسیداسیون الکل ها ارائه می دهند.
ترکیب اسید نیتریک با اسید سولفوریک : ابر واکنشگر نیتریل کننده و اکسیدکننده
ترکیب اسید نیتریک و سولفوریک ابر واکنشگری ایجاد می کند که هم نیترودار کننده و هم اکسیدکننده قوی است. اسید سولفوریک با پروتون دار کردن اسید نیتریک یون نیترونیوم (NO₂⁺) تولید می کند که عامل اصلی نیتراسیون ترکیبات آروماتیک است. این ترکیب در تولید TNT و سایر نیترو ترکیبات مانند نیتروبنزن و نیتروتولوئن که در رنگ ها و مواد منفجره استفاده می شوند حیاتی است. قدرت اکسیدکنندگی بالای آن نیز در فرآیندها نقش دارد.
اکسیداسیون غیرمستقیم با رادیکال های نیتروژن ناشی از اسید نیتریک
اسید نیتریک به رادیکال های نیتروژن مانند NO₂• تجزیه می شود که در اکسیداسیون غیرمستقیم نقش دارند. در محیط های آبی NO₂• با گونه های دیگر واکنش داده رادیکال های آزاد جدید تولید می کند و زنجیره واکنش اکسیداسیون را گسترش می دهد. در فاز گازی NO₂• مستقیما با ترکیبات آلی واکنش داده آنها را اکسید می کند. این رادیکال ها در فرآیندهای اتمسفری و صنعتی اهمیت دارند.
نقش غلظت اسید نیتریک در شدت واکنش های اکسیداسیون
غلظت اسید نیتریک به شدت بر قدرت اکسیدکنندگی آن تأثیر می گذارد. اسید نیتریک رقیق به عنوان یک اکسیدکننده ضعیف تر عمل می کند و اغلب اکسیدهای نیتروژن کمتر تولید می کند. اسید غلیظ اکسیدکننده قوی تری بوده و دی اکسید نیتروژن (NO₂) تولید می کند. اسید نیتریک دودکننده قوی ترین شکل بوده و به شدت اکسید می کند و گازهای سمی بیشتری تولید می کند.
کاربردهای صنعتی واکنش های اکسیداسیونی با اسید نیتریک
اکسیداسیون با اسید نیتریک در صنایع مختلف کاربرد وسیعی دارد. در صنعت داروسازی برای سنتز داروها و واسطه های دارویی استفاده می شود. در تولید مواد منفجره نیتراسیون ترکیبات آلی با اسید نیتریک نقش کلیدی دارد. در تصفیه فاضلاب برای از بین بردن آلاینده ها و اکسیداسیون مواد آلی به کار می رود. همچنین در صنعت پتروشیمی در تولید برخی از مواد شیمیایی واسطه ای و فرآیندهای اکسیداسیون به کار گرفته می شود.
نقش دما و فشار در کنترل واکنش های اکسیداسیون نیتریکی
دما و فشار پارامترهای کلیدی در کنترل واکنش های اکسیداسیون با اسید نیتریک هستند. افزایش دما سرعت واکنش را بالا برده اما خطر فرار گازهای سمی را نیز افزایش می دهد. به همین دلیل نیز باید واکنش های گرمازای اسید نیتریک و خطرات مرتبط با آن مورد توجه قرار گیرد. فشار بالا می تواند باعث افزایش غلظت واکنش دهنده ها و افزایش سرعت واکنش شود. در مقیاس صنعتی کنترل دقیق دما و فشار برای بهینه سازی بازده ، کاهش خطرات ایمنی و جلوگیری از واکنش های جانبی ضروری است. سیستم های کنترل دقیق دما و فشار جزء ضروری تجهیزات صنعتی به شمار می روند.
ملاحظات ایمنی هنگام کار با اسید نیتریک در واکنش های اکسیداسیون
اسید نیتریک ماده ای خورنده و اکسیدکننده قوی است. در آزمایشگاه ها و کارگاه های صنعتی باید از تجهیزات حفاظت فردی مانند دستکش ، عینک و روپوش استفاده شود. واکنش ها باید در هودهای شیمیایی انجام شوند. محیط کار باید تهویه مناسب داشته باشد. برای جلوگیری از انفجار مخلوط کردن اسید نیتریک با مواد آلی باید با احتیاط انجام شود. در صورت تماس با پوست یا چشم بلافاصله با آب فراوان شستشو داده و به پزشک مراجعه شود. ذخیره سازی اسید نیتریک نیز باید با رعایت کامل نکات ایمنی انجام شود.
معرفی واکنش های شاخص اکسیداسیون با اسید نیتریک در کتاب های شیمی آلی
کتاب های شیمی آلی واکنش های اکسیداسیون با اسید نیتریک را به طور گسترده پوشش می دهند. نیتراسیون آروماتیک از واکنش های شاخص است که با تشکیل یون نیترونیوم (NO₂⁺) از ترکیب اسید نیتریک و سولفوریک انجام می شود. اکسیداسیون الکل ها به کتون یا اسید کربوکسیلیک نیز مورد بحث قرار می گیرد. اکسیداسیون آلکان ها با اسید نیتریک نیز از جمله واکنش های مهم است. این واکنش ها به دلیل کاربرد وسیع در سنتز آلی به طور جزئی در کتاب های درسی شیمی آلی مطرح می شوند.




