فهرست عناوین
- مقدمه : اهمیت آمونیاک در صنعت شیمیایی و تولید اسید نیتریک
- اسید نیتریک چیست و چرا تولید آن اهمیت دارد ؟
- نقش آمونیاک به عنوان ماده اولیه در تولید اسید نیتریک
- فرآیند صنعتی تولید اسید نیتریک از آمونیاک : مروری بر روش اُستوَلد
- واکنش های شیمیایی کلیدی در تولید اسید نیتریک از آمونیاک
- نقش کاتالیزورها در اکسیداسیون آمونیاک و بهبود بازده تولید
- تأثیر دما و فشار بر کارایی فرآیند تولید اسید نیتریک
- نسبت مصرف آمونیاک به اسید نیتریک در تولید صنعتی
- کنترل آلاینده ها در فرآیند اکسیداسیون آمونیاک
- بررسی و مقایسه روشهای صنعتی تولید اسید نیتریک
- کاربردهای اسید نیتریک تولید شده از آمونیاک در صنایع مختلف
- اهمیت بازیافت انرژی در فرآیند تولید اسید نیتریک از آمونیاک
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 16-01-1404
تاریخ بروزرسانی مقاله : 16-01-1404
تعداد کلمات : 1400
آدرس مقاله : لینک مقاله
نقش آمونیاک در تولید اسید نیتریک

مقدمه : اهمیت آمونیاک در صنعت شیمیایی و تولید اسید نیتریک
آمونیاک (NH₃) ستون فقرات بسیاری از فرآیندهای صنعتی مهم است. نقش حیاتی آن در تولید اسید نیتریک ، آن را به ماده ای استراتژیک تبدیل کرده است. این ماده شیمیایی پرکاربرد در تولید کودهای ازته که برای کشاورزی ضروری هستند به کار می رود. همچنین آمونیاک پیش ساز بسیاری از مواد منفجره و سایر ترکیبات شیمیایی صنعتی است. اهمیت اقتصادی آمونیاک به دلیل نقش محوری اش در زنجیره تامین مواد شیمیایی و کشاورزی و خرید اسید نیتریک شیراز گالن 20 لیتری ، غیرقابل انکار است. در این مقاله به بررسی جزئیات نقش آمونیاک در فرآیند تولید اسید نیتریک خواهیم پرداخت. فرایند تولید اسید نیتریک از آمونیاک یک فرآیند صنعتی پیچیده و با اهمیت اقتصادی بالا می باشد.
اسید نیتریک چیست و چرا تولید آن اهمیت دارد ؟
اسید نیتریک (HNO₃) یک اسید معدنی قوی و خورنده است که کاربردهای گسترده ای در صنایع مختلف دارد. این ماده شیمیایی در تولید کودهای شیمیایی ازته مانند نیترات آمونیوم نقش اساسی ایفا می کند. همچنین در تولید مواد منفجره به عنوان یک اکسید کننده قوی مورد استفاده قرار می گیرد. صنعت فلزکاری نیز از اسید نیتریک برای فرآیندهایی مانند حکاکی و تمیزکاری فلزات استفاده می کند. تولید اسید نیتریک به دلیل تقاضای بالای آن در بخش های کشاورزی و صنایع نظامی و شیمیایی از اهمیت اقتصادی بالایی برخوردار است. این اهمیت باعث شده است که تحقیقات و توسعه در زمینه های تولید بهینه و ایمن اسید نیتریک همواره در کانون توجه قرار داشته باشد.
نقش آمونیاک به عنوان ماده اولیه در تولید اسید نیتریک
آمونیاک (NH₃) ماده اولیه ضروری در تولید اسید نیتریک (HNO₃) است. نیتروژن موجود در آمونیاک منبع اصلی نیتروژن در اسید نیتریک می باشد. در فرآیند تولید ، آمونیاک در حضور کاتالیزور پلاتین-رودیوم با اکسیژن واکنش داده و به مونوکسید نیتروژن (NO) تبدیل می شود. سپس NO با اکسیژن بیشتر واکنش داده و دی اکسید نیتروژن (NO₂) تشکیل می دهد. NO₂در نهایت با آب واکنش می دهد و اسید نیتریک و مونوکسید نیتروژن تولید می شود. NO تولید شده در این مرحله به چرخه بازگردانده می شود تا راندمان تولید افزایش یابد.
| ردیف | ویژگی | توضیح | واکنش مرتبط | اهمیت در فرآیند | کاربرد در صنعت |
|---|---|---|---|---|---|
| 1 | نام ماده | آمونیاک (Ammonia) | — | ماده پایه در فرآیند اکسایش | تولید کود، اسید نیتریک، مواد منفجره |
| 2 | فرمول شیمیایی | NH₃ | — | نشاندهنده ترکیب نیتروژن و هیدروژن | پایه بسیاری از ترکیبات نیتروژندار |
| 3 | حالت فیزیکی | گاز بیرنگ با بوی تند | — | بهراحتی در محیط منتقل میشود | به شکل مایع فشرده نیز ذخیره و حمل میشود |
| 4 | واکنش اصلی | 4 NH₃ + 5 O₂ → 4 NO + 6 H₂O | اکسایش آمونیاک به نیتریک اکسید (NO) | گام اول در تولید HNO₃ | پایه واکنشهای بعدی |
| 5 | گام دوم واکنش | 2 NO + O₂ → 2 NO₂ | اکسایش NO به NO₂ | آمادهسازی برای جذب در آب | تولید گاز پیشماده اسید |
| 6 | گام نهایی واکنش | 3 NO₂ + H₂O → 2 HNO₃ + NO | تشکیل اسید نیتریک | تولید مستقیم اسید نیتریک از NO₂ | خروجی نهایی فرآیند تولید HNO₃ |
فرآیند صنعتی تولید اسید نیتریک از آمونیاک : مروری بر روش اُستوَلد
فرآیند اُستوالد روش صنعتی غالب تولید اسید نیتریک از آمونیاک در کنار روش های جایگزین تولید اسید نیتریک است. این فرآیند شامل سه مرحله اصلی است : اول اکسیداسیون کاتالیستی آمونیاک به مونوکسید نیتروژن (NO) در دمای بالا (حدود 850 درجه سانتیگراد) و با استفاده از کاتالیزور پلاتین-رودیوم. دوم اکسیداسیون NO به دی اکسید نیتروژن (NO₂) در حضور اکسیژن. سوم جذب NO₂ در آب برای تولید اسید نیتریک (HNO₃) و مونوکسید نیتروژن (NO) که به مرحله اول برگردانده می شود. راندمان این فرآیند به عوامل مختلفی از جمله دما ، فشار ، غلظت واکنش دهنده ها و نوع کاتالیزور بستگی دارد. بهینه سازی این پارامترها برای دستیابی به حداکثر راندمان تولید اسید نیتریک ضروری است.
واکنش های شیمیایی کلیدی در تولید اسید نیتریک از آمونیاک
تولید اسید نیتریک از آمونیاک از طریق فرآیند Ostwald انجام می شود و شامل سه مرحله کلیدی است. مرحله اول اکسیداسیون کاتالیستی آمونیاک (NH₃) به مونوکسید نیتروژن (NO) است : 4NH₃ + 5O₂ → 4NO + 6H₂O این واکنش گرمازا بوده و در حضور کاتالیزور پلاتین-رودیوم اتفاق می افتد. در مرحله دوم NO به دی اکسید نیتروژن (NO₂) اکسید می شود : 2NO + O₂ → 2NO₂ این واکنش نسبتاً آهسته است. در مرحله آخر NO₂ در آب حل شده و اسید نیتریک (HNO₃) و مونوکسید نیتروژن (NO) تولید می شود : 3NO₂ + H₂O → 2HNO₃ + NO. NO تولید شده مجدداً به مرحله دوم باز می گردد.
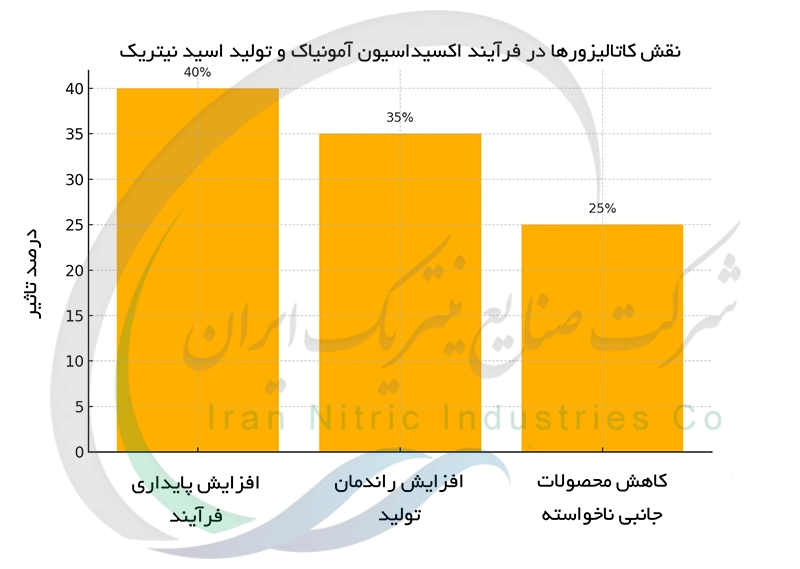
نقش کاتالیزورها در اکسیداسیون آمونیاک و بهبود بازده تولید
در فرآیند Ostwaldکاتالیزورهای پلاتین-رودیوم نقش حیاتی در اکسیداسیون آمونیاک به مونوکسید نیتروژن دارند. این کاتالیزورها سرعت واکنش را به طور قابل توجهی افزایش می دهند و به دستیابی به بازده بالاتر کمک می کنند. بدون کاتالیزور این واکنش در دمای بسیار بالا و با راندمان پایین انجام می شود. کاتالیزور پلاتین-رودیوم با کاهش انرژی فعال سازی واکنش سرعت اکسیداسیون آمونیاک را افزایش می دهد و به این ترتیب تولید اسید نیتریک را کارآمدتر و اقتصادی تر می سازد. علاوه بر افزایش سرعت ، کاتالیزورها به پایداری فرآیند و کاهش تولید محصولات جانبی ناخواسته نیز کمک می کنند.
تأثیر دما و فشار بر کارایی فرآیند تولید اسید نیتریک
دمای بهینه برای اکسیداسیون کاتالیستی آمونیاک به مونوکسید نیتروژن حدود 800-900 درجه سانتیگراد است. در این دما واکنش با سرعت مناسب و راندمان بالا انجام می شود. افزایش دما بیش از حد می تواند منجر به تخریب کاتالیزور و کاهش بازده شود. فشار نیز بر میزان تبدیل آمونیاک و بازده تولید اسید نیتریک تأثیر می گذارد. افزایش فشار سرعت واکنش را افزایش داده و راندمان را بهبود می بخشد. اما فشار بسیار بالا هزینه های تولید را افزایش می دهد. فشار عملیاتی معمولاً بین 2 تا 10 اتمسفر است. بهینه سازی دما و فشار برای حداکثر کردن راندمان و کاهش هزینه های تولید الزامی است.
نسبت مصرف آمونیاک به اسید نیتریک در تولید صنعتی
نسبت مصرف آمونیاک به اسید نیتریک در تولید صنعتی به غلظت اسید نیتریک تولیدی و راندمان فرآیند بستگی دارد. به طور معمول برای تولید یک تن اسید نیتریک با غلظت 68 درصد حدود 0.32 تن آمونیاک خالص مورد نیاز است. این نسبت بر اساس استوکیومتری واکنش ها و راندمان واقعی فرآیند محاسبه می شود. عوامل مختلفی مانند کیفیت آمونیاک ورودی ، کارایی کاتالیزور ، کنترل دقیق دما و فشار و طراحی راکتور بر این نسبت تاثیر می گذارند. به دست آوردن نسبت بهینه آمونیاک به اسید نیتریک برای بهینه سازی اقتصادی فرآیند تولید اسید نیتریک ضروری است. انحراف از این نسبت باعث اتلاف منابع و افزایش هزینه ها می شود.
کنترل آلاینده ها در فرآیند اکسیداسیون آمونیاک
اکسیداسیون آمونیاک در تولید اسید نیتریک گازهای NOx تولید می کند که آلاینده های خطرناک محیط زیستی هستند. کنترل این آلاینده ها از اهمیت بالایی برخوردار است. روش های مختلفی برای کاهش انتشار NOx به کار می رود. یکی از روش ها استفاده از کاتالیزورهای انتخابی کاهنده (SCR) است که NOx را به نیتروژن و آب تبدیل می کند. تزریق آمونیاک یا اوره به عنوان عامل کاهنده در این روش رایج است. روش دیگر استفاده از سیستم های جذب NOx است که از مواد جاذب برای حذف NOx از گازهای خروجی استفاده می کنند. بهینه سازی شرایط عملیاتی مانند دما و نسبت هوا به آمونیاک نیز در کاهش تولید NOx موثر است.
بررسی و مقایسه روشهای صنعتی تولید اسید نیتریک
روش Ostwald به دلیل راندمان بالا ، سادگی و مصرف انرژی بهینه روش غالب تولید اسید نیتریک است. این روش در مقایسه با روش های دیگر مانند روش قوس الکتریکی مزایای قابل توجهی دارد. روش قوس الکتریکی با عبور جریان الکتریکی از هوا اکسیدهای نیتروژن تولید می کند که سپس با آب واکنش داده و اسید نیتریک تولید می شود. این روش راندمان پایین تر و مصرف انرژی بیشتری نسبت به روش Ostwald دارد. روش های دیگر مانند روش تولید اسید نیتریک از نیترات ها محدودیت هایی در دسترسی به مواد اولیه و هزینه های تولید دارند. سادگی ، راندمان و صرفه اقتصادی روش Ostwald آن را به انتخاب برتر برای تولید صنعتی اسید نیتریک تبدیل کرده است.
کاربردهای اسید نیتریک تولید شده از آمونیاک در صنایع مختلف
به عنوان ماده اولیه در تولید کودهای شیمیایی نیتروژن دار مانند نیترات آمونیوم و نیترات کلسیم نقش حیاتی در کشاورزی ایفا می کند. در صنعت مواد منفجره برای تولید ترکیباتی مثل نیتروگلیسیرین و TNT استفاده می شود. در صنایع فلزکاری به عنوان یک عامل اسیدشویی برای تمیز کردن و آماده سازی سطح فلزات به کار می رود. همچنین در سنتز ترکیبات شیمیایی مختلف از جمله داروها ، رنگ ها و پلاستیک ها و در تصفیه آب و فاضلاب برای حذف ناخالصی ها به کار می رود.
اهمیت بازیافت انرژی در فرآیند تولید اسید نیتریک از آمونیاک
فرآیند Ostwald گرمازا بوده و مقدار قابل توجهی گرما تولید می کند. بازیافت این انرژی جنبه مهمی از تولید پایدار اسید نیتریک است. گرمای تولید شده می تواند برای تولید بخار با فشار بالا استفاده شود که در چرخه های تولید برق یا سایر فرآیندهای صنعتی به کار می رود. این امر موجب کاهش مصرف سوخت های فسیلی و در نتیجه کاهش انتشار گازهای گلخانه ای می شود. استفاده از سیستم های بازیافت انرژی ، هزینه های تولید را کاهش داده و راندمان کلی فرآیند را افزایش می دهد. طراحی کارآمد سیستم های بازیافت انرژی از نظر اقتصادی و زیست محیطی برای صنایع تولید اسید نیتریک حیاتی است.




