فهرست عناوین
- معرفی اسید نیتریک و کاربردهای صنعتی آن
- اهمیت بررسی خواص فیزیکی اسید نیتریک
- چگالی اسید نیتریک چیست و چگونه اندازه گیری می شود ؟
- تأثیر غلظت بر چگالی اسید نیتریک
- روش های آزمایشگاهی اندازه گیری چگالی اسید نیتریک
- نقطه جوش اسید نیتریک و شرایط اندازه گیری آن
- عوامل موثر بر تغییر نقطه جوش اسید نیتریک
- نقطه انجماد اسید نیتریک و رفتار آن در دماهای پایین
- مقایسه نقطه جوش و انجماد اسید نیتریک با دیگر اسیدهای معدنی
- چگالی ، نقطه جوش و انجماد در کاربردهای صنعتی اسید نیتریک
- تأثیر دما و فشار بر خواص فیزیکی اسید نیتریک
- نمودار تغییرات چگالی و نقطه جوش اسید نیتریک بر اساس غلظت
- نکات ایمنی مرتبط با خواص حرارتی اسید نیتریک
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 14-02-1404
تاریخ بروزرسانی مقاله : 14-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
چگالی ، نقطه جوش و نقطه انجماد اسید نیتریک

معرفی اسید نیتریک و کاربردهای صنعتی آن
اسید نیتریک ترکیب شیمیایی خورنده با فرمول HNO₃ ، مایعی بی رنگ و یا زرد کم رنگ است که در واکنش با آب گرما تولید می کند. این ماده اسیدی قوی به شمار می رود و در صنایع گوناگون نقشی حیاتی ایفا می کند. در تولید کودهای نیتروژنه به عنوان ماده اولیه به طور گسترده استفاده می شود و نقش کلیدی در کشاورزی مدرن دارد. صنعت داروسازی از این ترکیب در تولید برخی داروها بهره می برد. در تولید مواد منفجره مانند نیتروگلیسیرین و سایر ترکیبات مرتبط کاربرد چشمگیری دارد. علاوه بر این موارد اسید نیتریک در فرایندهای فلزیابی ، تصفیه آب و صنایع شیمیایی دیگر به کار می رود.
اهمیت بررسی خواص فیزیکی اسید نیتریک
شناخت دقیق ویژگی های فیزیکی اسید نیتریک از قبیل چگالی ، نقطه جوش و نقطه انجماد برای مدیریت ایمن این ماده شیمیایی الزامی است. چگالی بالا نشان دهنده ی تراکم بالای مولکول هاست و بر نحوه ی جابجایی و ذخیره سازی آن تاثیر می گذارد. نقطه جوش بالا دمای مورد نیاز برای تبخیر را تعیین می کند. از سوی دیگر نقطه انجماد پایین دمای شروع انجماد اسید را مشخص می سازد و در انتخاب شرایط ذخیره سازی مناسب حائز اهمیت است. آگاهی از این پارامترها از بروز حوادث ناشی از نشت ، آتش سوزی یا انجماد پیشگیری کرده و به استفاده صحیح و ایمن از اسید نیتریک کمک شایانی می کند.
چگالی اسید نیتریک چیست و چگونه اندازه گیری می شود ؟
چگالی اسید نیتریک معیاری از جرم موجود در واحد حجم آن است و به غلظت اسید وابسته است. هرچه غلظت اسید بیشتر باشد چگالی آن نیز بیشتر می شود. در شرایط استاندارد چگالی اسید نیتریک غلیظ (معمولا حدود ۶۸%) در حدود ۱.۵۱۲ گرم بر سانتی متر مکعب است. برای تعیین چگالی از روش های مختلفی استفاده می شود. یکی از روش های متداول استفاده از پیکرومتر است که با اندازه گیری جرم و حجم معینی از نمونه چگالی را به دست می آورد. روش های هیدرومتری نیز به وسیله ی ابزارهایی مانند هیدرومتر به صورت غیرمستقیم چگالی را تعیین می کنند.
| ردیف | درصد خلوص اسید نیتریک | چگالی (g/cm³) در دمای ۲۰°C | روش اندازهگیری | دمای مرجع | توضیحات تکمیلی |
|---|---|---|---|---|---|
| 1 | 100% | 1.513 | هیدرومتر | 20 درجه | خالصترین شکل اسید نیتریک |
| 2 | 70% | 1.42 | ترازوی دقیق + حجمسنج | 20 درجه | رایجترین نوع صنعتی |
| 3 | 55% | 1.33 | پیکنومتر | 20 درجه | در مصارف آزمایشگاهی |
| 4 | 40% | 1.25 | چگالیسنج نوری | 20 درجه | کمتر خورندهتر |
| 5 | 25% | 1.15 | روش وزنی-حجمی | 20 درجه | برای مصارف آموزشی |
| 6 | کمتر از 10% | ~1.05 | تقریبی/بصورت تجربی | 20 درجه | رقیق شده برای ایمنی بیشتر |
تأثیر غلظت بر چگالی اسید نیتریک
چگالی اسید نیتریک به عنوان شاخصی از تراکم جرم در حجم معین ارتباط مستقیم و خطی با غلظت آن دارد. در محلول های رقیق تر مولکول های آب فضای بیشتری را اشغال می کنند و در نتیجه چگالی کمتر می شود. با افزایش غلظت مولکول های اسید نیتریک به یکدیگر نزدیک تر شده و چگالی افزایش می یابد. اسید نیتریک ۶۸% به عنوان غلظت تجاری متداول دارای چگالی حدود ۱.۴۲ گرم بر سانتی متر مکعب است. این رابطه ابزاری کلیدی در تعیین غلظت اسید نیتریک برای خرید اسید نیتریک استخراج طلا از طریق اندازه گیری چگالی به شمار می رود و در کنترل کیفیت و کاربردهای صنعتی حائز اهمیت فراوان است. بنابراین شناخت این وابستگی برای به کارگیری ایمن و دقیق این ماده ضروری است.
روش های آزمایشگاهی اندازه گیری چگالی اسید نیتریک
اندازه گیری دقیق چگالی اسید نیتریک در آزمایشگاه با استفاده از ابزارهای دقیقی مانند پیکرومتر یا دانسی متر انجام می شود. پیکرومتر با تعیین دقیق حجم و جرم نمونه چگالی را به طور مستقیم محاسبه می کند. دانسی متر یا هیدرومتر با شناوری در مایع ، چگالی را به صورت غیرمستقیم از طریق مقایسه با مقیاس مدرج تعیین می کند. برای اطمینان از دقت اندازه گیری باید دما کنترل شود زیرا چگالی با دما تغییر می کند. روش های طیف سنجی نیز می توانند به طور غیرمستقیم غلظت و در نتیجه چگالی را با دقت بالا مشخص کنند.
نقطه جوش اسید نیتریک و شرایط اندازه گیری آن
نقطه جوش اسید نیتریک دمایی است که در آن فشار بخار مایع با فشار اتمسفر برابر شده و به جوش می آید. این نقطه برای اسید نیتریک غلیظ (حدود ۶۸%) در فشار ۱ اتمسفر تقریباً ۸۳ درجه سانتی گراد است. با این حال این نقطه به شدت به غلظت اسید و فشار محیط وابسته است. در غلظت های پایین تر نقطه جوش کمتر و در فشارهای بالاتر نقطه جوش بیشتر خواهد بود. اندازه گیری نقطه جوش به صورت دقیق نیاز به استفاده از ابزارهای مدرن و کنترل دقیق شرایط مثل فشار و دما دارد. تغییرات نقطه جوش با تغییر غلظت باید در موارد صنعتی و آزمایشگاهی مدنظر قرار گیرد.
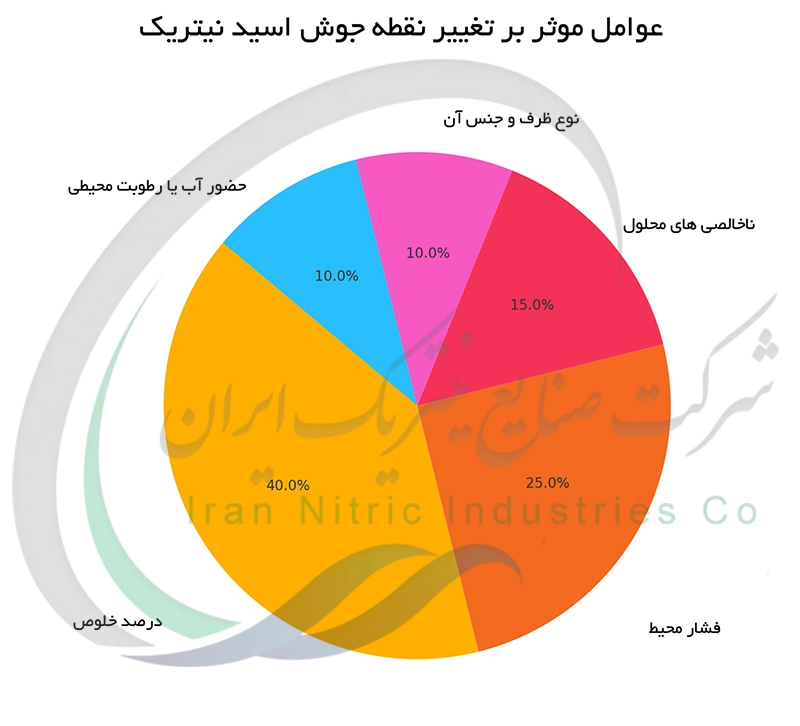
عوامل موثر بر تغییر نقطه جوش اسید نیتریک
نقطه جوش اسید نیتریک تابعی از چندین عامل متغیر است. حضور ناخالصی ها نظیر یون های فلزی یا سایر اسیدها به دلیل برهم کنش های بین مولکولی نقطه جوش را دستخوش تغییر می کند. فشار اتمسفر نیز نقش تعیین کننده ای ایفا می کند. با افزایش فشار نقطه جوش افزایش خواهد یافت. علاوه بر این میزان آب موجود در محلول اسید نیتریک تاثیر بسزایی در دمای جوش دارد. آب نقطه جوش اسید را پایین می آورد و محلول های رقیق تر نقطه جوش کمتری نسبت به اسید غلیظ دارند.
نقطه انجماد اسید نیتریک و رفتار آن در دماهای پایین
اسید نیتریک در دمای تقریبی منفی ۴۱ درجه سانتی گراد به حالت جامد تبدیل می شود. این ویژگی به ویژه در شرایط ذخیره سازی زمستانی اهمیت بالایی دارد. در دماهای پایین تر از نقطه انجماد اسید نیتریک جامد شده و ممکن است انبساط حجم داشته باشد که در صورت عدم رعایت اصول صحیح نگهداری موجب تخریب ظروف و نشت مواد شود. بنابراین ذخیره سازی در ظروف مقاوم به سرما و در مکان هایی با دمای کنترل شده برای پیشگیری از انجماد و بروز حوادث احتمالی ضروری است.
مقایسه نقطه جوش و انجماد اسید نیتریک با دیگر اسیدهای معدنی
اسید نیتریک با اسیدهای معدنی قوی دیگر مانند اسید سولفوریک و اسید کلریدریک در خصوصیات فیزیکی مانند نقطه جوش و انجماد تفاوت هایی اساسی دارد. اسید سولفوریک نقطه جوش بسیار بالاتری (حدود ۳۳۷ درجه سانتی گراد) و نقطه انجماد به مراتب بالاتر (۱۰ درجه سانتی گراد) نسبت به اسید نیتریک دارد. اسید کلریدریک نیز نقطه جوش پایین تر (حدود ۱۱۰۰ درجه سانتی گراد) و نقطه انجماد پایین تری (منفی ۱۱۴ درجه سانتی گراد) نسبت به اسید نیتریک از خود نشان می دهد. این تفاوت ها در رفتار حرارتی اسید نیتریک را برای کاربردهای خاص مثلاً در فرایندهای که نیازمند دمای متوسط هستند مناسب می سازد. در واقع دامنه حرارتی متفاوت این اسیدها نقش مهمی در انتخاب ماده مناسب برای هر کاربرد ایفا می کند.
چگالی ، نقطه جوش و انجماد در کاربردهای صنعتی اسید نیتریک
در صنایع شناخت دقیق چگالی ، نقطه جوش و انجماد اسید نیتریک برای عملیات ایمن و کارآمد ضروری است. چگالی بالا نیازمند طراحی مخازن مقاوم و سیستم های انتقال ویژه است. نقطه جوش پایین تر از سایر اسیدهای معدنی قوی محدودیت هایی را برای فرایندهای با دمای بالا ایجاد می کند. همچنین نقطه انجماد پایین لزوم ذخیره سازی در محیط های با دمای کنترل شده را نشان می دهد. این عوامل تعیین کننده ی انتخاب مواد ، فرایندها و تجهیزات در کاربردهای مختلف اسید نیتریک هستند ، از تولید کودهای شیمیایی تا صنایع داروسازی و تولید مواد منفجره.
تأثیر دما و فشار بر خواص فیزیکی اسید نیتریک
دما و فشار دو عامل کلیدی در تعیین ویژگی های فیزیکی اسید نیتریک هستند. افزایش دما چگالی را کاهش و نقطه جوش را افزایش می دهد. فشار بالا نیز نقطه جوش را بالا می برد. این تغییرات رفتار اسید را در فرایندهای مختلف از ذخیره سازی تا واکنش های شیمیایی دگرگون می کند. در صنایع حساس مانند تولید مواد منفجره یا داروسازی کنترل دقیق دما و فشار برای حفظ کیفیت و ایمنی بسیار مهم است. عدم در نظر گرفتن این عوامل به خطاهای عملیاتی و حوادث جدی منجر می شود.
نمودار تغییرات چگالی و نقطه جوش اسید نیتریک بر اساس غلظت
نمودارهای چگالی و نقطه جوش اسید نیتریک نسبت به غلظت رابطه مستقیم این دو پارامتر را نشان می دهند. با افزایش غلظت (درصد خلوص) ، چگالی افزایش و نقطه جوش بالا می رود. این نمودارها ابزاری کارآمد برای کنترل کیفیت و پیش بینی رفتار اسید در غلظت های مختلف هستند. استفاده از این نمودارها به صنایع کمک می کند تا غلظت مناسب را برای کاربردهای مختلف انتخاب کنند و از خطاهای ناشی از تغییرات چگالی و نقطه جوش جلوگیری کنند. به این ترتیب راندمان و ایمنی فرایندهای صنعتی بهبود می یابد.
نکات ایمنی مرتبط با خواص حرارتی اسید نیتریک
نقطه جوش نسبتا پایین اسید نیتریک (حدود ۸۳ درجه سانتیگراد در فشار اتمسفر) و گرمای نهان تبخیر آن خطرات خاصی را در بر دارد. بخارات حاصل از گرمایش یا جوشیدن اسید بسیار خورنده و سمی هستند. بنابراین نگهداری در ظروف مقاوم به حرارت و خورندگی ، تهویه مناسب محل کار ، استفاده از تجهیزات حفاظتی فردی نظیر عینک ، دستکش و روپوش مقاوم به اسید الزامی است. همچنین به دلیل واکنش های شیمیایی اسید نیتریک با فلزات ، باید از این قبیل مواد به صورت جداگانه نگهداری شود. از تماس مستقیم با پوست و چشم باید پرهیز شود. در صورت بروز هرگونه تماس فورا با آب فراوان شستشو داده و به پزشک مراجعه شود. آتش سوزی احتمالی ناشی از تبخیر و واکنش های گرماده با مواد خاموش کننده مناسب مهار شود.




