فهرست عناوین
- مقدمه
- نقاط عطف تاریخی در پژوهش اسید نیتریک
- ساختار شیمیایی و خواص اسید نیتریک
- روش های آزمایشگاهی و تولید اولیه
- فرایند استوالد و تولید صنعتی مدرن
- اسید نیتریک در تولید کود
- اسید نیتریک در مواد انفجاری و مهمات
- اسید نیتریک در سنتز آلی و صنایع شیمیایی
- کاربرد های اسید نیتریک در متالورژی، اچینگ و پالایش
- اسید نیتریک به عنوان سوخت راکتی و در هوافضا
- اثرات زیست محیطی و جوی اسید نیتریک
- کاربرد های آزمایشگاهی و تحلیلی اسید نیتریک
- اهمیت اقتصادی و صنعتی اسید نیتریک
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 29-09-1404
تاریخ بروزرسانی مقاله : 29-09-1404
تعداد کلمات : 3400
آدرس مقاله : لینک مقاله
پیشرفت های علمی در مطالعه اسید نیتریک

مقدمه
اسید نیتریک یک اسید معدنی قوی است که طی قرن ها نقشی محوری در علوم و صنایع ایفا کرده است. فرمول شیمیایی این ماده HNO3 می باشد و این مایع خورنده را کیمیاگران قدیم به نام آکوا فورتیس یا آب قوی می شناختند. با گذر زمان، دانشمندان درک خود را از خواص، تولید و کاربرد های اسید نیتریک به طور چشمگیری بهبود بخشیده است. از اکتشاف آن در آزمایشگاه های قرون وسطا گرفته تا کاربرد های مدرن در فناوری پیشرفته، اسید نیتریک همواره در مرکز بسیاری از پیشرفت های علمی بوده است. امروزه این ماده در تولید کودهای شیمیایی، مواد منفجره و بی شمار فرآیند شیمیایی نقش اساسی دارد و به همین دلیل موضوع تأمین مطمئن و صنعتی آن، از جمله خرید اسید نیتریک کارون، برای واحد های تولیدی و صنعتی اهمیت ویژه ای پیدا کرده است. در این مرور جامع، به بررسی نقاط عطف تاریخی، ویژگی های شیمیایی و کاربرد های متنوع اسید نیتریک می پردازیم و همچنین نوآوری های اخیر و جهت گیری های آینده در مطالعه آن را مرور می کنیم. هدف این است که نشان دهیم تحقیقات و توسعه های مداوم چگونه دانش ما را درباره این ترکیب حیاتی گسترش داده اند.
نقاط عطف تاریخی در پژوهش اسید نیتریک
داستان اسید نیتریک از آزمایشگاه های کیمیاگران آغاز می شود. متون اروپایی قرون وسطی در حوالی سده سیزدهم برای نخستین بار به ماده ای به نام آب قوی (aqua fortis) اشاره کردند که از حرارت دادن نمک نیترات با جوهر گوگرد به دست می آمد. روایت شده است که دانشمندانی مانند جابر بن حیان توانستند این آب قوی را که قادر به حل کردن فلزات بود شناسایی کنند. تا قرن هفدهم، شیمی دان هایی نظیر یوهان رودولف گلابر روش های عملی برای تولید اسید نیتریک خالص از تقطیر شوره (نیترات پتاسیم) با اسید سولفوریک ابداع کرده بودند. اواخر دهه 1700 میلادی، پیشگامانی چون آنتوان لاووازیه و هنری کاوندیش عناصر تشکیل دهنده اسید نیتریک را شناسایی کردند و نشان دادند که این اسید می تواند از اکسیدهای نیتروژن موجود در هوا تشکیل شود. آزمایش معروف کاوندیش که در آن جرقه های الکتریکی را از هوای مرطوب عبور داد و اسید نیتریک تولید کرد، نشان داد که صاعقه چگونه نیترات طبیعی ایجاد می کند. در طول قرن نوزدهم، با مطالعه واکنش ها و کاربرد های اسید نیتریک، اهمیت این ماده بیش از پیش آشکار شد. اوایل قرن بیستم، نوآوران صنعتی مانند ویلهلم استوالد فرایند هایی را برای تولید انبوه اسید نیتریک از آمونیاک معرفی کردند و بدین ترتیب صنایع مدرن کود و مواد منفجره ممکن شدند. جدول زیر برخی از مهم ترین پیشرفت های علمی در درک و تولید اسید نیتریک را در طول قرون برجسته می کند:
| سال/دوره | دانشمند(ان) | دستاورد | توضیحات | اهمیت |
|---|---|---|---|---|
| حدود 1300 میلادی | جابر بن حیان (منسوب) | اولین توصیف اسید نیتریک | توصیف "آب قوی" از طریق تقطیر شوره (نمک پتاس) با زاج و نمک های دیگر | معرفی اسیدهای معدنی به دنیای شیمی و امکان انجام واکنش های جدید روی فلزات |
| 1785 | هنری کاوندیش | سنتز از هوا | تولید اسید نیتریک با تخلیه الکتریکی در هوای مرطوب | نشان داد امکان تثبیت نیتروژن وجود دارد و ترکیب اسید نیتریک فاش شد |
| 1846 | کریستین شونبین | نیتروسلولز (پنبه باروت) | کشف کرد که خیساندن پنبه در اسید نیتریک ماده ای بسیار آتش گیر و منفجره تولید می کند | اولین ماده منفجره نوین که بر صنایع نظامی و معدنکاری تأثیر گذاشت |
| 1847 | آسکانیو سوبررو | نیتروگلیسیرین | با نیتراسیون گلیسیرین، نیتروگلیسیرین مایع فوق العاده قوی و ناپایدار را سنتز کرد | زمینه ساز ساخت دینامیت و انفجارهای قوی در معدن و عمران شد |
| 1908 | ویلهلم استوالد | فرایند استوالد | ابداع اکسیداسیون کاتالیزی آمونیاک به اسید نیتریک با استفاده از کاتالیست پلاتین | امکان تولید انبوه اسید نیتریک را فراهم کرد و صنایع بزرگ کود و مهمات را رونق داد |
| دهه 1970 | دانشمندان محیط زیست | ارتباط با باران اسیدی | شناسایی شد که اسید نیتریک حاصل از آلاینده های NOx یکی از عوامل باران اسیدی است که محیط زیست را اسیدی می کند | منجر به وضع مقررات زیست محیطی برای کاهش آلودگی هوا و حفاظت از آب و خاک شد |
| دهه 1980 | شیمی دانان جوی | شیمی لایه ازون | کشف شد که اسید نیتریک در ابرهای استراتوسفری قطبی به تخریب لایه ازون کمک می کند | درک شیمی جو را پیش برد و به سیاست گذاری جهانی برای حفاظت از ازون انجامید |
| دهه 2010 | مهندسان شیمی | روش های تولید سبز | کاتالیست ها و فرآیندهای الکتروشیمیایی جدید برای تولید مستقیم HNO3 از هوا و آب با انرژی کمتر توسعه یافت | هدف آن افزایش پایداری و تمرکززدایی در تولید اسید نیتریک است |
ساختار شیمیایی و خواص اسید نیتریک
اسید نیتریک (HNO3) مولکولی متشکل از یک اتم نیتروژن و سه اتم اکسیژن است که یکی از این اکسیژن ها به یک اتم هیدروژن نیز متصل می باشد. این ساختار، اسید نیتریک را به یک اسید تک پروتونی بسیار قوی تبدیل کرده است که در آب به طور کامل یونیزه شده و یون نیترات (NO3-) و هیدرونیوم (H3O+) آزاد می کند. اسید نیتریک خالص بی رنگ است، اما نمونه های کهنه به دلیل تجزیه به گاز دی اکسید نیتروژن به رنگ زرد در می آیند. وقتی در معرض هوا قرار گیرد، اسید نیتریک غلیظ بخارات تند و زننده آزاد می کند اگر تقریبا خالص باشد بخارات آن سفید است و اگر حاوی NO2 زیادی باشد بخارات قهوه ای مایل به قرمز دیده می شود. نقطه جوش اسید نیتریک بی آب 83 درجه سانتیگراد است و با آب یک آزئوتروپ تشکیل می دهد که در حدود 68% غلظت می جوشد. از نظر شیمیایی، اسید نیتریک تنها یک اسید قوی نیست بلکه یک عامل اکسید کننده قدرتمند نیز محسوب می شود. این اسید می تواند با بسیاری از فلزات و ترکیبات آلی واکنش شدیدی داشته باشد و اغلب طی این واکنش ها گاز های سمی اکسید نیتروژن تولید می شوند. برای مثال اسید نیتریک مس فلزی را اکسید کرده و به نیترات مس تبدیل می کند که همراه با آن گاز نیتریک اکسید یا دی اکسید نیتروژن آزاد می گردد. به دلیل همین ویژگی های قوی و خورنده، باید هنگام کار با اسید نیتریک احتیاط شود، اما همین ویژگی ها آن را برای انجام واکنش نیتراسیون و حل کردن موادی که در برابر اسید های ضعیف تر مقاوم اند بی نهایت ارزشمند کرده است.
روش های آزمایشگاهی و تولید اولیه
قرن ها است که اسید نیتریک به روش های کوچک مقیاس و با استفاده از منابع معدنی در دسترس تهیه می شد. روش های سنتی آزمایشگاهی شامل مخلوط کردن یک نمک نیترات مانند نیترات پتاسیم (شوره) با اسید سولفوریک غلیظ و حرارت دادن این مخلوط بود. این فرایند که نخستین بار توسط گلابر در دهه 1600 میلادی بهینه سازی شد، بخارات اسید نیتریک تولید می کند که با سرد کردن به مایع تبدیل می شوند. در قرن نوزدهم، بخش عمده اسید نیتریک از واکنش ذخایر طبیعی نیترات سدیم (شوره شیلی) با اسید سولفوریک در مقیاس صنعتی به دست می آمد. یک نقطه عطف دیگر در اوایل دهه 1900 میلادی فرآیند بیرکلند-اید در نروژ بود که تلاش کرد با عبور هوا از یک قوس الکتریکی دمای بالا، نیتروژن اتمسفر را تثبیت کند. محصول این فرایند گاز نیتریک اکسید بود که می شد آن را به اسید نیتریک تبدیل کرد، اما این روش انرژی بسیار زیادی مصرف می کرد. اگرچه این تکنیک های اولیه نشان دادند که می توان از هوا یا منابع معدنی اسید نیتریک تولید کرد، اما از نظر بازده در مقایسه با استاندارد های مدرن ناکارآمد بودند. همین روش های ابتدایی زمینه را برای فرآیند های کارآمدتر بعدی فراهم کردند و نشان دادند که با ورود جهان به قرن بیستم، تقاضا برای اسید نیتریک به منظور تولید کود و مواد منفجره به شدت رو به افزایش است.
فرایند استوالد و تولید صنعتی مدرن
انقلاب واقعی در تولید اسید نیتریک با فرایند استوالد رقم خورد که توسط شیمیدان آلمانی ویلهلم استوالد در اوایل دهه 1900 معرفی شد. با تکیه بر فرآیند تازه توسعه یافته هابر برای تولید آمونیاک مصنوعی، روش استوالد امکان اکسید کردن کارآمد آمونیاک (NH3) به اسید نیتریک را فراهم ساخت. در فرآیند استوالد، ابتدا گاز آمونیاک در حضور کاتالیزور داغ از جنس پلاتین-رودیوم با اکسیژن واکنش داده و به نیتریک اکسید (NO) تبدیل می شود. سپس نیتریک اکسید بیشتر اکسید شده و به دی اکسید نیتروژن (NO2) تبدیل می گردد. در نهایت گاز NO2 در آب جذب می شود که طی آن واکنش داده و اسید نیتریک تولید می کند. این توالی چند مرحله ای واکنش ها گرمازا بوده و پس از آغاز شدن خودپایدار است و گاز های واکنش نکرده نیز برای بیشینه کردن بازده بازیافت می شوند. فرایند استوالد بسیار اقتصادی تر از روش های قبلی تثبیت نیتروژن از هوا بود و به سرعت به استاندارد اصلی برای تولید انبوه اسید نیتریک در جهان بدل گشت. طی دهه ها، بهبود های مهندسی از جمله شبکه های کاتالیزوری بهتر و سیستم های بازیابی حرارت این فرایند را حتی پربازده تر کرده اند. امروزه تقریباً تمام تولید صنعتی اسید نیتریک در مقیاس بزرگ بر اصول فرآیند استوالد متکی است و سالانه میلیون ها تن از این اسید را برای پاسخ به تقاضای جهانی فراهم می کند.
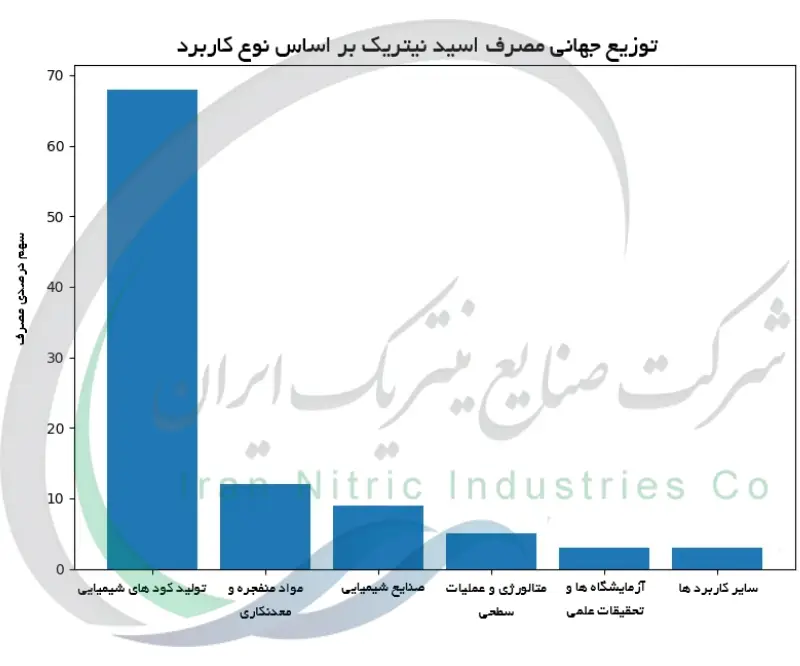
اسید نیتریک در تولید کود
با امکان پذیر شدن تولید انبوه، کشاورزی به بزرگترین مصرف کننده اسید نیتریک تبدیل شد. اسید نیتریک برای ساخت کود های حاوی نیتروژن که تغذیه گیاهان زراعی را تأمین می کنند ضروری است. مهم ترین مسیر کاربرد آن خنثی سازی اسید نیتریک با آمونیاک و تشکیل نیترات آمونیوم (NH4NO3) است که کودی غنی از نیتروژن محسوب می شود. نیترات آمونیوم منبع نیترات قابل جذب برای گیاهان در خاک فراهم می کند. از اوایل قرن بیستم، دسترسی به مقادیر فراوان اسید نیتریک از طریق فرآیند استوالد به کارخانه های کود شیمیایی امکان داد تا نیترات آمونیوم را در حجم عظیم تولید کنند. این امر با تأمین مواد مغذی ازتی ارزان برای مزارع، به وقوع انقلاب سبز و افزایش تولید محصولات کشاورزی کمک کرد. علاوه بر نیترات آمونیوم، از اسید نیتریک برای تولید کود هایی مانند نیترات کلسیم آمونیوم و سایر کودهای حاوی نیترات نیز استفاده می شود. پیشرفت های علمی مدرن بر بهبود کارایی مصرف کود و کاهش آسیب های زیست محیطی متمرکز بوده است. برای مثال، ساخت کود های کنترل رهش و به کارگیری روش های مدیریتی بهتر در کشاورزی تلاش دارند آبشویی نیترات اضافی به منابع آب را به حداقل برسانند. با این حال، کودهای مبتنی بر اسید نیتریک همچنان پایه ی کشاورزی جهانی هستند و پیشرفت ها در شیمی اسید نیتریک مستقیماً با افزایش بهره وری کشاورزی پیوند خورده است.
اسید نیتریک در مواد انفجاری و مهمات
اسید نیتریک نقشی بدنام اما بسیار مهم در توسعه مواد انفجاری داشته است. قدرت نیتراسیون بالای HNO3 (که اغلب به همراه اسید سولفوریک استفاده می شود) امکان می دهد گروه های نیترو به مولکول های آلی افزوده شوند و ترکیبات آنها را به مواد منفجره تبدیل کنند. در میانه قرن نوزدهم، شیمی دانان کشف کردند که تماس پنبه (سلولز) با اسید نیتریک نوعی نیترات سلولز تولید می کند که ماده ای بسیار آتشگیر و منفجره (پنبه باروت) است. تقریباً همزمان، آسکانیو سوبررو با نیتراسیون گلیسرین، نیتروگلیسیرین را تهیه کرد که یک مایع انفجاری فوق العاده قوی است. این اکتشافات به سرعت توسط آلفرد نوبل و دیگران برای ساخت مواد منفجره کاربردی به کار گرفته شدند دینامیت (نیتروگلیسیرین جذب شده در خاک جاذب) و باروت بی دود از نیتروسلولز. در سال های بعد، از اسید نیتریک برای سنتز تری نیتروتولوئن (TNT) با نیتراسیون تولوئن نیز استفاده شد که به یکی از پرمصرف ترین مواد منفجره نظامی تبدیل گردید. پیشرفت های علمی در درک شیمی نیتراسیون مستقیماً این اختراعات را ممکن ساخت. حتی امروزه بسیاری از مهمات و مواد انفجاری مورد استفاده در معدنکاری ترکیباتی بر پایه نیتروژن هستند که به واسطه شیمی اسید نیتریک تولید می شوند. اگرچه نقش اسید نیتریک در فناوری مواد انفجاری همراه با مخاطرات است، اما بی شک بخش کلیدی از میراث آن در پیشرفت علمی و صنعتی به شمار می رود.
اسید نیتریک در سنتز آلی و صنایع شیمیایی
فراتر از کود و مواد منفجره، اسید نیتریک به عنوان یک معرف حیاتی در شیمی آلی برای تولید طیف گسترده ای از مواد شیمیایی به کار رفته است. توانایی این اسید در افزودن گروه نیترو به حلقه های آروماتیک (از طریق نیتراسیون) آن را برای تولید واسطه های مورد نیاز در صنایع رنگ و داروسازی ضروری می کند که این موضوع به خوبی نقش اسید نیتریک در توسعه فناوری و صنعت را در سطح جهانی نشان می دهد. برای مثال، نیتراسیون بنزن منجر به تولید نیتروبنزن می شود که با احیا به آنیلین تبدیل می گردد ماده ی اولیه ای برای ساخت فوم های پلی یورتان، رنگ ها و داروها. به همین ترتیب، اسید نیتریک در سنتز نیتروفنل ها و ترکیبات دیگری که در ساخت مسکن ها، مواد ضدعفونی و عطرها به کار می روند نقش دارد. اسید نیتریک همچنین به عنوان یک اکسید کننده قوی در برخی واکنش ها استفاده می شود. یک نمونه مهم صنعتی، تولید اسید آدیپیک (پیش ماده نایلون) از طریق اکسیداسیون سیکلوهگزانون/سیکلوهگزانول با اسید نیتریک است. پیشرفت های علمی کنترل واکنش های نیتراسیون را بهبود بخشیده اند و امکان دستیابی به بازده بالاتر و محصولات جانبی کمتر را فراهم کرده اند. پژوهش در شیمی آلی همچنان به بررسی فرآیندهای نیتراسیون با استفاده از اسید نیتریک ادامه دارد و به دنبال کاتالیزورهای انتخابی تر و روش های سازگارتر با محیط زیست می باشد. در مجموع، HNO3 همچنان یک ماده پایه در تولید بی شمار ترکیبات آلی مورد نیاز جامعه است که نشانگر همه کاره بودن آن فراتر از کاربرد های مشهورترش می باشد.
کاربرد های اسید نیتریک در متالورژی، اچینگ و پالایش
واکنش پذیری شدید اسید نیتریک در متالورژی و فرآوری مواد مورد استفاده قرار گرفته است. برای مثال، در صنعت فولاد زنگ نزن، از محلول های رقیق اسید نیتریک برای اسیدشویی و غیر فعال سازی سطح فولاد استفاده می شود تا زنگار و آلودگی های آهنی زدوده شده و لایه اکسید محافظ تشکیل گردد. اسید نیتریک همچنین جزئی از تیزاب سلطانی مخلوط اسید نیتریک و هیدروکلریک است که یکی از معدود واکنشگر هایی می باشد که قادر به حل کردن فلزات نجیب مانند طلا و پلاتین است. این خاصیت قرن ها در پالایش و خالص سازی طلا به کار گرفته شده است و امکان استخراج طلای خالص از آلیاژ ها یا ضایعات را فراهم می کند. هنرمندان و حکاکان فلز نیز از دیرباز برای حکاکی نقوش روی لوح های فلزی از اسید نیتریک استفاده کرده است، به طوری که این اسید بخش های بدون پوشش را به صورت انتخابی خورده و طرح دلخواه را ایجاد می کند. در صنایع الکترونیک و شیشه سازی مدرن، اسید نیتریک به تمیزکاری و آماده سازی سطوح کمک می کند؛ به عنوان نمونه، این اسید با زدودن باقی مانده های آلی و آثار فلزی می تواند ویفر های سیلیکونی و لام های شیشه ای را تمیز کند. حتی در فناوری هسته ای نیز از اسید نیتریک برای حل کردن سوخت هسته ای مصرف شده در فرآوری مجدد استفاده می شود تا فلزات پرتوزا تفکیک و برای بازیافت استخراج شوند. این کاربرد های متنوع نشان می دهند که چگونه پیشرفت های علمی، از توان بالای اسید نیتریک برای ابداع روش های عملی در حوزه های گوناگون بهره گرفته اند.
اسید نیتریک به عنوان سوخت راکتی و در هوافضا
یکی از فصل های کمتر شناخته شده در تاریخ اسید نیتریک، استفاده از آن به عنوان اکسید کننده در پیش رانش راکتی است. در میانه قرن بیستم، به ویژه در برنامه های اولیه فضایی و موشک های نظامی، اسید نیتریک غلیظ یک اکسید کننده مایع پایدار برای سوخت رسانی به راکت ها فراهم می کرد. انواعی مانند اسید نیتریک دودکننده قرمز (RFNA) و اسید نیتریک دودکننده سفید به همراه سوخت هایی نظیر هیدرازین یا نفت سفید به کار می رفتند تا ترکیبات هایپروگل ایجاد کنند که با تماس مشتعل می شدند. برای مثال، در موشک های قاره پیما و برخی پرتابگر های مداری، از پیشران های مبتنی بر اسید نیتریک استفاده شد زیرا در دمای محیط مایع می مانند و بر خلاف اکسیژن مایع نیازی به سرمایش شدید ندارند. با این حال، کار با اسید نیتریک در موشک ها به دلیل خورندگی و دود های سمی آن خطرناک بود و همین امر باعث شد در بسیاری از سامانه ها به استفاده از اکسید کننده های ایمن تر (مانند دی نیتروژن تتراکسید) روی آورند. با این وجود، دوره پژوهش روی پیشران های HNO3 دانش مهندسی ارزشمندی به همراه داشت. این تحقیقات نشان داد که اسید نیتریک می تواند فراتر از جو زمین نیز پیشرفت های فناورانه واقعی را ممکن سازد. امروزه اگرچه در راکت های مدرن به ندرت از اسید نیتریک استفاده می شود، میراث آن در هوافضا گستره تاثیر این ماده را در شاخه های مختلف علمی یادآور می شود.
اثرات زیست محیطی و جوی اسید نیتریک
کاربرد وسیع اسید نیتریک و انتشار اکسید های نیتروژن حاصل از آن پیامد های زیست محیطی قابل توجهی به دنبال دارد. در لایه های پایین جو، اسید نیتریک در شکل گیری باران اسیدی سهیم است. دی اکسید نیتروژن (NO2) متصاعد شده از خودروها و نیروگاه ها با بخار آب واکنش داده و اسید نیتریک تولید می کند که همراه بارش به زمین می افتد. باران اسیدی حاصل به جنگل ها آسیب می زند، pH آب های سطحی را کاهش داده و به آبزیان لطمه می زند و به تدریج سازه های ساختمانی و آثار تاریخی را فرسایش می دهد. مطالعات علمی در دهه 1970 برای اولین بار توجهات را به اسید نیتریک باران به عنوان یک عامل عمده اسیدی شدن محیط جلب کرد که به وضع قوانینی برای کنترل انتشار NOx منجر شد. در لایه های بالایی جو نیز اسید نیتریک نقش دارد: این ترکیب می تواند در اتمسفر فوقانی به صورت کریستال های ریز در ابرهای استراتوسفری قطبی متراکم شود. دریافته شد که این ذرات تری هیدرات اسید نیتریک در واکنش هایی که لایه اوزون را تخریب می کنند مشارکت دارند و با آزادسازی کلر فعال به کاهش اوزون منجر می شوند. این کشف در دهه 1980 برای فهم پدیده سوراخ شدن لایه اوزون در قطب جنوب حیاتی بود و در شکل گیری سیاست های بین المللی مانند پروتکل مونترال نقش داشت. بنابراین، اسید نیتریک از یک سو بخشی طبیعی از چرخه نیتروژن در اتمسفر است و از سوی دیگر در صورت تولید بیش از حد یک آلاینده زیان بار است که پژوهش ها برای پایش و کاهش اثرات آن همچنان ادامه دارند.
کاربرد های آزمایشگاهی و تحلیلی اسید نیتریک
اسید نیتریک به علت توانایی حل کردن گستره وسیعی از مواد، مدت هاست که به عنوان یک واکنشگر اصلی در آزمایشگاه ها به کار می رود. در شیمی تجزیه، اسید نیتریک فوق خالص برای هضم نمونه ها در تجزیه عنصری استفاده می شود و مواد آلی و معدنی پیچیده را به محلول تبدیل می کند. تکنیک هایی مانند ICP-MS (طیف سنجی جرمی پلاسمای جفت شده القایی) و جذب اتمی نیازمند آن هستند که نمونه ها ابتدا توسط اسید نیتریک هضم شده و به محلول شفاف بدون ذرات جامد تبدیل شوند. محلول های پاک کننده اسیدی حاوی اسید نیتریک نیز برای شستشوی شیشه آلات آزمایشگاهی و حذف ناخالصی های فلزی به کار می روند تا مطمئن شوند که نتایج آزمایش تحت تاثیر مواد مزاحم قرار نمی گیرد. در پژوهش های مربوط به مواد، از اسید نیتریک برای خالص سازی اکسیداتیو نانولوله های کربنی و گرافن یا آلایش پلیمر های رسانا استفاده می شود که کاربرد آن را در فناوری نانو نشان می دهد. دانشمندان روش های استانداردی را توسعه داده اند که از اسید نیتریک برای کار هایی مانند اندازه گیری نیترات در نمونه های آب محیطی یا آزمون برخی آلکالوئید ها استفاده می کنند. وجود اسید نیتریک در این تعداد از دستورالعمل های آزمایشگاهی نشان می دهد که جامعه علمی تا چه حد قابلیت های شیمیایی آن را برای اهداف تحلیلی دقیق بررسی و به کار گرفته است.
اهمیت اقتصادی و صنعتی اسید نیتریک
اسید نیتریک نه تنها از نظر علمی مهم است بلکه از لحاظ اقتصادی نیز حیاتی می باشد. این ماده از نظر حجم تولید در زمره پرمصرف ترین مواد شیمیایی جهان قرار دارد و سالانه ده ها میلیون تن از آن تولید می شود. این حجم عظیم تولید عمدتاً توسط صنعت کودهای شیمیایی هدایت می شود، اما نیاز به اسید نیتریک در تولید مواد منفجره، پلیمر ها و دیگر مواد شیمیایی نیز نقش دارد. مناطق عمده تولید شامل چین، هند، ایالات متحده، روسیه و اروپا هستند که بازتاب دهنده تقاضای عمومی برای آن در اقتصاد های توسعه یافته و در حال توسعه می باشد. دسترسی به اسید نیتریک در مقیاس وسیع از دیرباز با منافع ملی گره خورده است برای مثال جهت تامین امنیت غذایی و تولید مهمات. نوسانات قیمت انرژی و مواد اولیه (مانند گاز طبیعی برای آمونیاک) می تواند مستقیماً هزینه تولید اسید نیتریک را تحت تاثیر قرار دهد و اقتصاد آن را به بازار های جهانی منابع متصل می کند. از دید تجاری، بهبود های پیوسته در کارایی کارخانه ها و کنترل انتشار آلاینده ها برای حفظ سودآوری تولید و همگام شدن با مقررات زیست محیطی ضروری بوده است. چون اسید نیتریک تا این حد در کشاورزی و صنعت نقش مرکزی دارد، بازار آن شاخصی از وضعیت صنعت به شمار می رود. سرمایه گذاری در فناوری های تولید سبزتر و توسعه ظرفیت در کشور های در حال توسعه نشان می دهد که اسید نیتریک در آینده قابل پیش بینی نیز کماکان یک کالای بسیار با اهمیت خواهد بود.





تحقیقات معاصر درباره نقش اسید نیتریک در علم مواد و بررسی چالش ها و محدودیت های استفاده از این ماده