فهرست عناوین
- مقدمه ای بر اسید نیتریک و خصوصیات شیمیایی آن
- اسید نیتریک و واکنش های آن با فلزات
- واکنش اسید نیتریک با فلزات فعال
- واکنش اسید نیتریک با فلزات گران بها
- واکنش اسید نیتریک با فلزات غیرآهنی
- نقش دما در واکنش های اسید نیتریک با فلزات
- واکنش اسید نیتریک با آهن و تولید اکسیدهای آهن
- واکنش اسید نیتریک با مس و اثرات آن
- تولید گازهای سمی در واکنش اسید نیتریک با فلزات
- واکنش اسید نیتریک با فلزات در صنایع مختلف
- چگونه اسید نیتریک به عنوان یک اکسیدکننده عمل می کند ؟
- واکنش های اسید نیتریک با فلزات و تأثیر آن بر خوردگی فلزات
- واکنش اسید نیتریک با آلومینیوم و تولید نمک های آلومینیوم
- تأثیر غلظت اسید نیتریک بر نوع واکنش ها با فلزات
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 22-02-1404
تاریخ بروزرسانی مقاله : 22-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
واکنش های شیمیایی اسید نیتریک با فلزات

مقدمه ای بر اسید نیتریک و خصوصیات شیمیایی آن
اسید نیتریک (HNO₃)مایعی بی رنگ و خورنده با بوی تند و زننده است. این اسید قوی یک اکسید کننده قدرتمند نیز محسوب می شود. چگالی آن بالا و نقطه جوش آن نسبتاً پایین است. اسید نیتریک در آب به طور کامل یونیزه می شود و یون های هیدرونیوم (H₃O⁺) و نیترات (NO₃⁻) تولید می کند. کاربردهای گسترده ای از جمله در تولید کودهای شیمیایی ، مواد منفجره و در صنایع شیمیایی مختلف دارد. خاصیت خورندگی بالای آن ایجاب می کند که با احتیاط کامل با آن کار شود.
اسید نیتریک و واکنش های آن با فلزات
واکنش اسید نیتریک با فلزات پیچیده و وابسته به غلظت اسید و نوع فلز است. در غلظت های رقیق اسید نیتریک مانند دیگر اسیدهای قوی با فلزات واکنش داده و نمک نیترات و گاز هیدروژن تولید می کند. با این حال در غلظت های غلیظ اسید نیتریک به عنوان یک اکسید کننده قوی عمل می کند. در این حالت معمولاً گازهای نیتروژن دی اکسید (NO₂)، نیتریک اکسید (NO) یا حتی نیتروژن آزاد تولید می شود و نمک نیترات مربوط به فلز به عنوان محصول جانبی به دست می آید. این واکنش ها به طور کلی گرمازا هستند.
واکنش اسید نیتریک با فلزات فعال
فلزات قلیایی و قلیایی خاکی مانند سدیم ، پتاسیم و کلسیم بسیار فعال هستند و با اسید نیتریک رقیق واکنش شدیدی نشان می دهند. این واکنش ها با تولید نمک نیترات مربوطه و آزاد شدن مقدار زیادی گرما همراه هستند. به دلیل فعالیت بالای این فلزات واکنش با اسید نیتریک غلیظ نیز بسیار سریع و شدید می باشد. در این واکنش ها به جای هیدروژن معمولاً گازهای اکسید نیتروژن تولید می شوند. کنترل این واکنش ها به دلیل سرعت و شدت بالا چالش برانگیز است.
| ردیف | فلز فعال | شرایط واکنش | نوع محصول اصلی | گاز آزاد شده | مشاهدهی ظاهری و تغییرات |
|---|---|---|---|---|---|
| 1 | منیزیم (Mg) | اسید نیتریک رقیق | نیترات منیزیم (Mg(NO₃)₂) | گاز نیتروژن دیاکسید (NO₂) | ایجاد گرما، گاز قهوهای، حل شدن سریع |
| 2 | آلومینیوم (Al) | اسید نیتریک غلیظ | نیترات آلومینیوم (Al(NO₃)₃) | گاز نیتروژن دیاکسید (NO₂) | تولید گرما، حباب گاز، کدر شدن محلول |
| 3 | روی (Zn) | اسید نیتریک نیمهرقیق | نیترات روی (Zn(NO₃)₂) | گاز نیتریک اکسید (NO) | حبابزایی، محلول بیرنگ تا زرد کمرنگ |
| 4 | آهن (Fe) | اسید نیتریک غلیظ | نیترات آهن (Fe(NO₃)₃) | مخلوط NO و NO₂ | تغییر رنگ محلول به قهوهای مایل به قرمز |
| 5 | سدیم (Na) | اسید نیتریک رقیق | نیترات سدیم (NaNO₃) | نیتروژن و بخار شدید | واکنش انفجاری و بسیار سریع |
| 6 | پتاسیم (K) | اسید نیتریک رقیق | نیترات پتاسیم (KNO₃) | نیتروژن و بخار زیاد | واکنش شدید، گاز فراوان، نور و حرارت زیاد |
واکنش اسید نیتریک با فلزات گران بها
طلا و نقره فلزات گران بهایی با مقاومت بالا در برابر اسید نیتریک رقیق هستند. پیوندهای فلزی قوی در ساختار این فلزات به همراه پتانسیل اکسایش پایین موجب این مقاومت می شود. اسید نیتریک رقیق توانایی اکسید کردن این فلزات را ندارد. با این حال اسید نیتریک غلیظ و داغ در حضور اسید هیدروکلریک (آکوا رگیا) توانایی حل کردن طلا را دارد. این به دلیل تشکیل یون های پیچیده کلرو آورات(III) است که موجب کاهش پتانسیل اکسایش طلا می شود. نقره در آکوا رگیا حل می شود و نیترات نقره تولید می کند. به همین دلیل نیز می بایست برای انجام این امور ، خرید اسید نیتریک بازیافت طلا بهترین گزینه می باشد.
واکنش اسید نیتریک با فلزات غیرآهنی
فلزات غیرآهنی مانند آلومینیوم ، مس و روی در واکنش با اسید نیتریک رفتارهای متفاوتی از خود نشان می دهند. آلومینیوم با اسید نیتریک رقیق واکنش می دهد و اکسید آلومینیوم تشکیل می دهد که لایه محافظی روی سطح فلز ایجاد می کند. در غلظت های بالاتر آلومینیوم با اسید نیتریک واکنش داده و نمک نیترات آلومینیوم و اکسیدهای نیتروژن تولید می کند. مس در اسید نیتریک غلیظ حل می شود و نیترات مس(II) و اکسید نیتروژن تولید می کند. روی نیز در اسید نیتریک رقیق و غلیظ واکنش می دهد و نیترات روی و اکسیدهای نیتروژن تولید می کند. محصولات و سرعت واکنش به غلظت اسید و دما بستگی دارد.
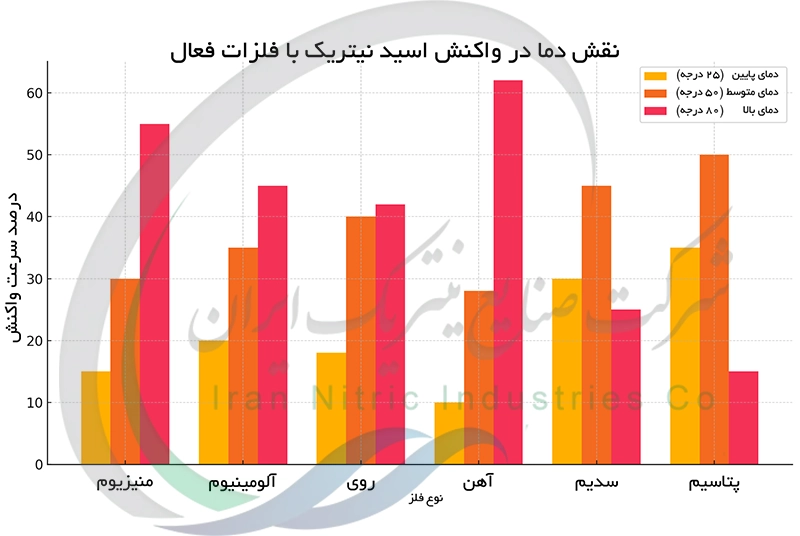
نقش دما در واکنش های اسید نیتریک با فلزات
دما ، سرعت و شدت واکنش اسید نیتریک با فلزات را به طور قابل توجهی تحت تاثیر قرار می دهد. افزایش دما انرژی جنبشی ذرات را افزایش می دهد در نتیجه برخوردهای موثر بین اسید و فلز بیشتر شده و سرعت واکنش بالا می رود. در دماهای بالا اسید نیتریک به عنوان اکسید کننده قوی تر عمل می کند و اکسیدهای نیتروژن با درجه اکسایش پایین تر مانند نیتریک اکسید (NO)جایگزین دی اکسید نیتروژن (NO₂) می شود. همچنین افزایش دما موجب تغییرات فیزیکی مانند افزایش سرعت انحلال و تغییر در ویسکوزیته اسید می شود. این تغییرات بر سینتیک واکنش تاثیر می گذارند.
واکنش اسید نیتریک با آهن و تولید اکسیدهای آهن
واکنش اسید نیتریک با آهن به غلظت اسید بستگی دارد. اسید رقیق نیترات آهن (II) و گاز هیدروژن تولید می کند. اسید غلیظ تر نیترات آهن (III) و اکسیدهای نیتروژن تولید می کند. در شرایط خاص اکسیداسیون آهن توسط اسید نیتریک می تواند منجر به تشکیل اکسیدهای آهن مانند هماتیت (Fe₂O₃) و مگنتیت (Fe₃O₄) شود. این اکسیدها رنگ های متفاوتی دارند (هماتیت قرمز و مگنتیت سیاه). غلظت اسید و دما ترکیب و مقدار اکسیدهای آهن حاصل را تعیین می کنند.
واکنش اسید نیتریک با مس و اثرات آن
اسید نیتریک با مس واکنش می دهد و نیترات مس(II) و اکسیدهای نیتروژن معمولاً NO₂ - گاز قهو ه ای تولید می کند. این واکنش سطح مس را از رنگ قرمز به سبز (به دلیل تشکیل نیترات مس) تغییر می دهد. غلظت اسید نیتریک شدت و سرعت واکنش را تعیین می کند. اسید غلیظ تر واکنش سریع تر و قوی تری ایجاد می کند. گاز NO₂ سمی است و باید با تهویه مناسب از محیط حذف شود. رنگ سبز سطح مس نشان دهنده ی تشکیل نمک نیترات مس است.
تولید گازهای سمی در واکنش اسید نیتریک با فلزات
برخی واکنش های اسید نیتریک با فلزات به ویژه با فلزات کم فعال و اسید غلیظ گازهای سمی مانند نیتروژن دی اکسید (NO₂) تولید می کنند. NO₂گازی قهوه ای رنگ ، خفه کننده و بسیار خطرناک است که می تواند به ریه ها آسیب برساند. استفاده از سیستم های تهویه قوی و تجهیزات حفاظت فردی (PPE) در این واکنش ها الزامی است. مدیریت صحیح این گازها شامل استفاده از هودهای شیمیایی ، ماسک های تنفسی مناسب و تجهیزات ایمنی برای جلوگیری از استنشاق و تماس با پوست است. باید از تجمع گاز در محیط آزمایشگاه جلوگیری کرد.
واکنش اسید نیتریک با فلزات در صنایع مختلف
اسید نیتریک نقش کلیدی در صنایع گوناگون دارد. در تولید مواد منفجره واکنش آن با ترکیبات آلی منجر به تشکیل مواد منفجره ای نظیر نیتروگلیسیرین می شود. در صنایع فلزی از اسید نیتریک برای حکاکی و تمیزکاری فلزات استفاده می شود. واکنش آن با فلزاتی مانند مس و نقره محلول های نیترات فلزی تولید می کند که در صنایع الکترونیک و آبکاری کاربرد دارند. خالص سازی فلزات از طریق حل کردن ناخالصی ها در اسید نیتریک نیز روشی معمول است. کنترل دقیق شرایط واکنش از جمله غلظت اسید و دما برای دستیابی به محصول مورد نظر و افزایش راندمان فرآیند حیاتی است.
چگونه اسید نیتریک به عنوان یک اکسیدکننده عمل می کند ؟
اسید نیتریک یک اکسید کننده قوی است. یون نیترات (NO₃⁻) در اسید نیتریک توانایی پذیرش الکترون از فلزات را دارد. این پذیرش الکترون موجب کاهش نیترات به گونه های مختلف نیتروژن مانند NO₂ یا NO می شود. فلزات در این واکنش ها الکترون از دست می دهند و به یون های فلزی تبدیل می شوند. قدرت اکسیدکنندگی اسید نیتریک به غلظت آن ، دما و نوع فلز واکنش دهنده بستگی دارد. غلظت بالاتر اسید و دمای بیشتر ، اکسیداسیون قوی تری را به دنبال دارد. این فرآیند اکسیداسیون محصولات متنوعی از جمله نیترات های فلزی و اکسیدهای نیتروژن ایجاد می کند.
واکنش های اسید نیتریک با فلزات و تأثیر آن بر خوردگی فلزات
اسید نیتریک به دلیل خاصیت خورندگی شدید باعث خوردگی بسیاری از فلزات می شود. این خوردگی از طریق اکسیداسیون فلز و تشکیل ترکیبات فلزی قابل حل در اسید رخ می دهد. این واکنش ها به تجهیزات و سازه های فلزی آسیب جدی وارد می کنند. برای جلوگیری از خوردگی از پوشش های محافظتی مانند رنگ ها ، روکش های فلزی (آبکاری) یا استفاده از مواد مقاوم در برابر اسید نیتریک استفاده می شود. انتخاب مواد سازگار با اسید نیتریک ، طراحی مناسب سیستم های نگهداری و استفاده از بازدارنده های خوردگی از جمله راهکارهای مقابله با خوردگی ناشی از اسید نیتریک هستند.
واکنش اسید نیتریک با آلومینیوم و تولید نمک های آلومینیوم
آلومینیوم با اسید نیتریک رقیق واکنش نشان می دهد و لایه نازکی از اکسید آلومینیوم (Al₂O₃) روی سطح آن تشکیل می شود. این لایه محافظ واکنش بیشتر را کند می کند. با این حال در اسید نیتریک غلیظ تر و گرم تر این لایه محافظ حل شده و واکنش ادامه می یابد. نیترات آلومینیوم [Al(NO₃)₃] محصول اصلی این واکنش است. علاوه بر این اکسیدهای نیتروژن مانند NO یا NO₂ نیز تولید می شوند. نوع و مقدار اکسیدهای نیتروژن تولیدی به غلظت اسید و دما بستگی دارد. واکنش اسید نیتریک غلیظ با آلومینیوم واکنشی گرمازا و شدید است.
تأثیر غلظت اسید نیتریک بر نوع واکنش ها با فلزات
غلظت اسید نیتریک عامل تعیین کننده در نوع محصول واکنش با فلزات است. در اسید رقیق اسید نیتریک مانند یک اسید معمولی عمل کرده و هیدروژن آزاد می کند (البته در واکنش با فلزات فعال). نمک نیترات فلز مربوطه نیز تولید می شود. افزایش غلظت اسید نقش اکسیدکنندگی آن را افزایش می دهد. در اسید غلیظ اسید نیتریک به عنوان اکسید کننده قوی عمل کرده و گازهای اکسید نیتروژن (NO, NO₂, N₂O₄) تولید می کند. در این حالت درجه اکسایش فلز در نمک نیترات می تواند بالاتر باشد مثلاً آهن در اسید رقیق Fe²⁺ و در اسید غلیظ Fe³⁺. بنابراین غلظت اسید تعیین کننده نوع گازهای آزاد شده و درجه اکسایش فلز در محصول نهایی است.




