فهرست عناوین
- مقدمه ای بر اسید نیتریک
- تعریف اسید نیتریک و فرمول شیمیایی آن
- فرآیند تولید اسید نیتریک در مقیاس آزمایشگاهی
- مواد اولیه ضروری برای تولید اسید نیتریک
- اهمیت آمونیاک در تولید اسید نیتریک
- تاثیر اکسیژن در تولید اسید نیتریک
- نقش کاتالیزورها در فرآیند تولید اسید نیتریک
- گاز نیتروژن دی اکسید (NO₂) و فرآیند تولید اسید نیتریک
- آب مقطر در فرآیند تولید اسید نیتریک
- اهمیت دمای واکنش در تولید اسید نیتریک
- استانداردهای کیفیت مواد اولیه برای تولید اسید نیتریک
- کاربردهای اسید نیتریک و تقاضا برای تولید آن
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 01-01-1404
تاریخ بروزرسانی مقاله : 01-01-1404
تعداد کلمات : 1400
آدرس مقاله : لینک مقاله
مواد اولیه مورد نیاز برای تولید آزمایشگاهی اسید نیتریک

مقدمه ای بر اسید نیتریک
اسید نیتریک یک ترکیب شیمیایی بسیار مهم و پرکاربرد با فرمول HNO₃ است که در طیف وسیعی از صنایع نقش اساسی ایفا می کند. این اسید قوی و خورنده در تولید کودهای شیمیایی نیتروژنه ضروری برای رشد گیاهان کاربرد گسترده ای دارد و نقش حیاتی در امنیت غذایی جهانی ایفا می کند. در صنعت شیمی به عنوان یک عامل اکسیدکننده و نیتره کننده در سنتز بسیاری از ترکیبات آلی و معدنی مورد استفاده قرار می گیرد. در داروسازی به عنوان پیش ماده در تولید برخی داروها و مواد ضدعفونی کننده به کار می رود. همچنین در تولید مواد منفجره و برخی از صنایع دیگر نیز کاربرد دارد. اهمیت اقتصادی و صنعتی اسید نیتریک به خاطر نقش کلیدی آن در تولید محصولات مختلف و تأثیر آن بر اقتصاد جهانی غیر قابل انکار است.
تعریف اسید نیتریک و فرمول شیمیایی آن
اسید نیتریک یک اسید معدنی قوی با فرمول شیمیایی HNO₃ است. این اسید یک مایع بی رنگ و خورنده است که با آب به هر نسبتی مخلوط می شود. خواص شیمیایی اسید نیتریک آن را به عنوان یک عامل اکسیدکننده قوی و یک عامل نیتره کننده قدرتمند معرفی می کند. این اسید در واکنش های شیمیایی با آزادسازی یون های هیدروژن (H⁺) و نیترات (NO₃⁻) به عنوان یک اسید مونوپروتیک عمل می کند. انواع مختلف اسید نیتریک با غلظت های متفاوت وجود دارند که کاربردهای متفاوتی دارند از جمله اسید نیتریک غلیظ (با غلظت بیش از 90%) و اسید نیتریک رقیق. غلظت اسید نیتریک به طور مستقیم بر قدرت اکسیدکنندگی و نیتره کنندگی آن تأثیر می گذارد. استفاده از اسید نیتریک نیازمند احتیاط و رعایت کامل نکات ایمنی است.
فرآیند تولید اسید نیتریک در مقیاس آزمایشگاهی
در مقیاس آزمایشگاهی اسید نیتریک معمولاً از طریق اکسیداسیون آمونیاک به دست می آید. در ادامه نیز به مقایسه تولید آزمایشگاهی و صنعتی اسید نیتریک خواهیم پرداخت. این روش با عبور مخلوط گازی آمونیاک و هوا از روی یک کاتالیزور پلاتین-رودیوم داغ آغاز می شود. در این مرحله آمونیاک به مونوکسید نیتروژن (NO) تبدیل می شود. سپس NO با اکسیژن موجود در هوا واکنش داده و دی اکسید نیتروژن (NO₂) را تولید می کند. NO₂ در آب حل شده و اسید نیتریک رقیق ایجاد می کند. برای دستیابی به اسید نیتریک غلیظ تر می توان از تکنیک تقطیر استفاده کرد. این فرایند در دستگاهی مجهز به کوره ، راکتور ، مبدل حرارتی و یک سیستم تقطیر انجام می شود ضمن اینکه کنترل دقیق دما و فشار از اهمیت بالایی برخوردار است.
مواد اولیه ضروری برای تولید اسید نیتریک
مهم ترین ماده اولیه در سنتز اسید نیتریک آمونیاک (NH₃) است که منبع نیتروژن را تأمین می کند. اکسیژن (O₂)به عنوان اکسیدکننده نقش اساسی در تبدیل آمونیاک به اکسیدهای نیتروژن دارد. کاتالیزور پلاتین-رودیوم نیز به عنوان یک تسریع کننده ی واکنش ضروری است. آب (H₂O) نیز برای حل کردن اکسیدهای نیتروژن و تشکیل اسید نیتریک رقیق مورد نیاز است. علاوه بر این خلوص بالای مواد اولیه به ویژه آمونیاک برای به دست آوردن محصولی با کیفیت بالا و راندمان مناسب ضروری بوده و تقاضا برای خرید اسید نیتریک شیراز گالن 20 لیتری را نیز افزایش می دهد. استفاده از مواد اولیه با ناخالصی کم از بروز مشکلات در فرآیند و آلودگی محصول جلوگیری می کند.
| ردیف | نام ماده اولیه | فرمول شیمیایی | حالت فیزیکی | نقش در فرآیند | نکات ایمنی مهم |
|---|---|---|---|---|---|
| 1 | اسید سولفوریک | H₂SO₄ | مایع | عامل اکسنده و آبگیر | خورنده شدید، استفاده از دستکش و عینک ضروری است |
| 2 | نیترات پتاسیم | KNO₃ | جامد | منبع نیترات | قابل اشتعال، دور از حرارت نگهداری شود |
| 3 | آب مقطر | H₂O | مایع | رقیقسازی یا تنظیم دما | اطمینان از خلوص بالا |
| 4 | یخ (برای خنکسازی) | H₂O (جامد) | جامد | کنترل دمای واکنش | در تماس مستقیم استفاده نشود |
| 5 | ظروف شیشهای مقاوم | — | — | نگهداری و ترکیب مواد | باید تحمل حرارت بالا داشته باشند |
| 6 | هود شیمیایی | — | — | ایمنی و تهویه | برای جلوگیری از استنشاق بخارات سمی ضروری است |
اهمیت آمونیاک در تولید اسید نیتریک
این ترکیب منبع اصلی نیتروژن در این سنتز محسوب می شود. در مرحلهی اول آمونیاک در مجاورت کاتالیزور پلاتین-رودیوم و با حضور اکسیژن به مونوکسید نیتروژن (NO) اکسید می شود. این واکنش گرمازا بنیان فرآیند را تشکیل می دهد. خلوص بالای آمونیاک برای حصول بازده مطلوب و جلوگیری از ناخالصی در محصول نهایی بسیار مهم است. مقدار آمونیاک مصرفی به طور مستقیم بر میزان اسید نیتریک تولیدی تاثیر می گذارد. کنترل دقیق دبی و غلظت آمونیاک از عوامل کلیدی در بهینه سازی این فرآیند صنعتی است.
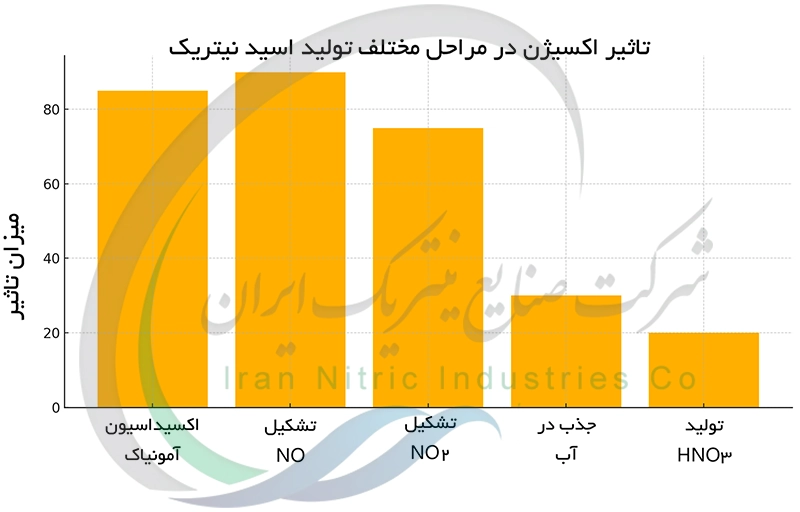
تاثیر اکسیژن در تولید اسید نیتریک
اکسیژن نقش محوری در اکسیداسیون کاتالیستی آمونیاک مراحل اولیه تولید اسید نیتریک دارد. بدون حضور اکسیژن کافی تبدیل آمونیاک به مونوکسید نیتروژن (NO) به طور کامل انجام نمی شود و راندمان تولید به شدت کاهش می یابد. در واقع اکسیژن به عنوان عامل اکسیدکننده در دو مرحلهی کلیدی این فرآیند دخالت دارد. اول در اکسیداسیون آمونیاک به NO و دوم در اکسیداسیون NO به دی اکسید نیتروژن NO₂. NO₂ حاصل در نهایت در آب حل شده و اسید نیتریک را تشکیل می دهد. بنابراین تأمین اکسیژن کافی با خلوص مناسب برای حصول یک واکنش موثر و به دست آوردن اسید نیتریک با کیفیت بالا الزامی است. کنترل دقیق میزان اکسیژن از مهم ترین پارامترهای بهینه سازی این فرآیند محسوب می شود.
نقش کاتالیزورها در فرآیند تولید اسید نیتریک
بدون استفاده از کاتالیزور این واکنش بسیار کند و ناکارآمد خواهد بود. آلیاژ پلاتین-رودیوم به عنوان کاتالیزور اصلی در این فرآیند به طور قابل توجهی انرژی فعال سازی واکنش را کاهش می دهد و سرعت تبدیل آمونیاک به مونوکسید نیتروژن را افزایش می دهد. ساختار ویژه این آلیاژ باعث جذب و فعال سازی مولکول های آمونیاک و اکسیژن می شود و راندمان تولید اسید نیتریک را به طور چشمگیری بهبود می بخشد. استفاده از کاتالیزور با خلوص بالا برای حصول اطمینان از راندمان و کیفیت بالای محصول حائز اهمیت است.
گاز نیتروژن دی اکسید (NO₂) و فرآیند تولید اسید نیتریک
نیتروژن دی اکسید (NO₂) یک ترکیب واسطه ی کلیدی در تولید اسید نیتریک است. این گاز قهوه ای رنگ از اکسیداسیون مونوکسید نیتروژن (NO) حاصل از اکسیداسیون کاتالیستی آمونیاک به دست می آید. NO₂ یک عامل اکسید کننده قوی است و نقش مهمی در واکنش نهایی تولید اسید نیتریک دارد. در این مرحلهNO₂ در آب حل می شود و در یک واکنش تعادلی اسید نیتریک و مونوکسید نیتروژن تشکیل می دهند. برای افزایش راندمان تولید اسید نیتریک باید شرایط واکنش به نحوی تنظیم شود که حلالیت NO₂ در آب به حداکثر برسد.
آب مقطر در فرآیند تولید اسید نیتریک
آب مقطر به عنوان حلال در سنتز آزمایشگاهی اسید نیتریک نقشی حیاتی ایفا می کند. خلوص بالای آب مقطر از ورود ناخالصی ها به فرآیند و آلودگی محصول نهایی جلوگیری می کند. دی اکسید نیتروژن (NO₂)محصول میانی واکنش در آب مقطر حل شده و اسید نیتریک رقیق را تشکیل می دهد. غلظت اسید نیتریک تولیدی به میزان آب مقطر مصرفی وابسته است. استفاده از حجم بیشتر آب اسیدی رقیق تر و بالعکس اسیدی غلیظ تر تولید می کند. کنترل دقیق میزان آب مقطر برای دستیابی به غلظت مطلوب اسید نیتریک ضروری است. عدم استفاده از آب مقطر و جایگزینی آن با آب معمولی به دلیل وجود املاح و یون های اضافی باعث کاهش راندمان و آلودگی محصول می شود.
اهمیت دمای واکنش در تولید اسید نیتریک
در مرحله ی اکسیداسیون کاتالیستی آمونیاک دمای بالا (حدود 800-900 درجه سانتیگراد) برای فعال شدن کاتالیزور و دستیابی به سرعت واکنش مطلوب لازم است. کنترل دقیق دما در این مرحله از اهمیت بالایی برخوردار است زیرا دمای بسیار بالا یا پایین به کاتالیزور آسیب رسانده و یا راندمان واکنش را کاهش می دهد. در مراحل بعدی مانند جذب دی اکسید نیتروژن در آب ، دمای پایین تر به منظور افزایش حلالیت و به حداکثر رساندن بازده اسید نیتریک مطلوب است.
استانداردهای کیفیت مواد اولیه برای تولید اسید نیتریک
تولید اسید نیتریک با کیفیت بالا مستلزم استفاده از مواد اولیه با خلوص و ویژگی های مشخص است. آمونیاک مورد استفاده باید عاری از هرگونه ناخالصی باشد تا از ممانعت در واکنش و آلودگی محصول نهایی جلوگیری شود. اکسیژن نیز باید با خلوص بالا و عاری از رطوبت باشد. کاتالیزور پلاتین-رودیوم باید از نظر ترکیب و ساختار استانداردهای تعیین شده را برآورده کند تا کارایی مطلوب را تضمین کند. آب مقطر نیز باید عاری از هرگونه یون یا ماده ی محلول باشد. رعایت این استانداردها نقش اساسی در اطمینان از بازده و کیفیت اسید نیتریک تولیدی ایفا می کند.
کاربردهای اسید نیتریک و تقاضا برای تولید آن
اسید نیتریک ماده ای با کاربردهای گسترده در صنایع گوناگون است. در تولید کودهای شیمیایی ازت دار به عنوان منبع نیتروژن نقش اصلی را ایفا می کند. صنعت تولید مواد منفجره نیز به میزان قابل توجهی به این اسید نیازمند است. علاوه بر این اسید نیتریک در سنتز ترکیبات آلی ، پردازش فلزات و تولید داروها نیز کاربرد دارد. تقاضای رو به رشد برای کودهای شیمیایی و سایر محصولات مرتبط موجب افزایش تقاضا برای اسید نیتریک در مقیاس صنعتی می شود. به موازات آن نیاز به تولید این اسید در مقیاس آزمایشگاهی برای پژوهش ها و توسعه ی روش های جدید تولید و کاربردهای نوین آن نیز رو به افزایش است.




