فهرست عناوین
- معرفی کلی اسید نیتریک : اسیدی فراتر از آزمایشگاه
- فرمول شیمیایی اسید نیتریک به زبان ساده
- ساختار لوویس اسید نیتریک : پیوندها چگونه تشکیل می شوند ؟
- پیوندهای شیمیایی در اسید نیتریک : کووالانسی یا یونی ؟
- زاویه های پیوندی و شکل فضایی اسید نیتریک
- ساختار رزونانسی یون نیترات (NO₃⁻)
- خواص فیزیکی مرتبط با ساختار مولکولی
- اسید نیتریک در واکنش های شیمیایی : ساختار چگونه رفتار را تعیین می کند ؟
- اثر ساختار بر خاصیت اکسیدکنندگی اسید نیتریک
- رفتار اسید نیتریک در محلول های آبی
- مقایسه ساختار اسید نیتریک با سایر اسیدهای معدنی
- تأثیر ساختار بر ذخیره سازی و حمل اسید نیتریک
- مدلسازی مولکولی اسید نیتریک با نرم افزارهای شیمیایی
- فرمول مولکولی vs فرمول تجربی : تفاوت ها در اسید نیتریک
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 31-02-1404
تاریخ بروزرسانی مقاله : 31-02-1404
تعداد کلمات : 1500
آدرس مقاله : لینک مقاله
فرمول شیمیایی و ساختار مولکولی اسید نیتریک

معرفی کلی اسید نیتریک : اسیدی فراتر از آزمایشگاه
اسید نیتریک (HNO₃) یک اسید معدنی قوی ، بی رنگ و خورنده با کاربردهای گسترده در صنایع مختلف است. از تولید کودهای شیمیایی و مواد منفجره گرفته تا تصفیه فلزات و سنتز ترکیبات آلی ، نقش اسید نیتریک انکارناپذیر است. قدرت اکسیدکنندگی بالای آن در واکنش های شیمیایی بسیاری ، آن را به ماده ای حیاتی در تولید مواد مختلف تبدیل کرده است. علاوه بر این در صنایع دارویی و آزمایشگاهی نیز کاربردهای فراوانی دارد. اما به دلیل ماهیت خورنده و خطرناک آن باید با رعایت کامل نکات ایمنی با آن کار کرد. استفاده از تجهیزات حفاظتی مناسب مانند دستکش ، عینک و روپوش آزمایشگاهی برای جلوگیری از آسیب های پوستی و چشمی ضروری است.
فرمول شیمیایی اسید نیتریک به زبان ساده
فرمول شیمیایی اسید نیتریک HNO₃ است که نشان دهنده ی وجود یک اتم هیدروژن (H)، یک اتم نیتروژن (N) و سه اتم اکسیژن (O) در هر مولکول آن است. این فرمول به سادگی ترکیب شیمیایی این اسید را نشان می دهد. هر چند این فرمول ساده پیچیدگی ساختار مولکولی و پیوندهای شیمیایی آن را به طور کامل نمایان نمی کند. برای درک بهتر این جنبه ها باید به ساختار لوویس آن توجه شود. این ساختار چگونگی اتصال اتم ها و توزیع الکترون ها در مولکول اسید نیتریک را نشان می دهد.
ساختار لوویس اسید نیتریک : پیوندها چگونه تشکیل می شوند ؟
ساختار لوویس اسید نیتریک نشان می دهد که اتم نیتروژن در مرکز قرار دارد و با پیوندهای کووالانسی به سه اتم اکسیژن متصل است. یکی از اتم های اکسیژن پیوند دوگانه با نیتروژن دارد در حالی که دو اتم اکسیژن دیگر پیوندهای یگانه دارند. اتم هیدروژن از طریق یک پیوند کووالانسی به یکی از اتم های اکسیژن پیوند خورده است. این آرایش منجر به وجود یک بار منفی بر روی یکی از اتم های اکسیژن و یک بار مثبت جزئی بر روی اتم هیدروژن می شود که علت خاصیت اسیدی قوی اسید نیتریک است. توزیع الکترون ها در ساختار لوویس رفتار شیمیایی اسید نیتریک را توضیح می دهد.
پیوندهای شیمیایی در اسید نیتریک : کووالانسی یا یونی ؟
پیوندهای درون مولکول اسید نیتریک (بین نیتروژن و اکسیژن ها و همچنین بین اکسیژن و هیدروژن) از نوع کووالانسی هستند. یعنی اتم ها الکترون های خود را با هم به اشتراک می گذارند. اما در محلول آبی پیوند بین اتم هیدروژن و گروه نیترات (NO₃⁻) قطبی است و به راحتی می شکند. این شکستن پیوند یون هیدروژن (H⁺) و یون نیترات (NO₃⁻) را آزاد می کند. آزاد شدن یون H⁺ از اسید نیتریک و تشکیل یون هیدرونیوم (H₃O⁺) سبب افزایش اسیدیته ی محلول می شود. بنابراین در حالی که پیوندهای درون مولکولی کووالانسی هستند ، رفتار اسیدی اسید نیتریک بر اساس ماهیت یونی آن در محلول آبی است.
| شماره | بخش مورد بررسی در اسید نیتریک | نوع پیوند | یونی یا کووالانسی؟ | قطبی یا غیرقطبی؟ | توضیحات |
|---|---|---|---|---|---|
| ۱ | پیوند بین H و O (گروه OH) | کووالانسی | کووالانسی قطبی | قطبی | پیوند بین هیدروژن و اکسیژن از نوع کووالانسی است چون الکترونها مشترکند، اما به دلیل اختلاف الکترونگاتیوی، قطبی است. |
| ۲ | پیوند بین N و O (اول) | کووالانسی | کووالانسی قطبی | قطبی | پیوند معمولی بین نیتروژن و اکسیژن که دارای طول پیوند مشخص است. |
| ۳ | پیوند بین N و O (دوم) | کووالانسی | کووالانسی دوقطبی (رزونانسی) | قطبی | این پیوند نوعی پیوند رزونانسی است که بین یک پیوند یگانه و پیوند دوگانه در نوسان است. |
| ۴ | پیوند بین N و O (اکسیژن با بار منفی) | کووالانسی | کووالانسی قطبی | قطبی | اکسیژنی که دارای بار منفی است با نیتروژن پیوند کووالانسی قطبی برقرار میکند. |
| ۵ | پیوند بین یون H⁺ و یون NO₃⁻ | یونی | یونی | قطبی | وقتی اسید نیتریک در آب حل میشود، به یونهای H⁺ و NO₃⁻ تفکیک میشود که پیوند بین آنها یونی است. |
| ۶ | ساختار کلی مولکول HNO₃ | ترکیبی | هم کووالانسی، هم یونی | قطبی | مولکول اسید نیتریک دارای پیوندهای کووالانسی در ساختار مولکولی خود و پیوند یونی پس از یونیزاسیون در محلول آبی است. |
زاویه های پیوندی و شکل فضایی اسید نیتریک
اتم نیتروژن مرکزی در اسید نیتریک هیبریداسیون sp² دارد که منجر به ساختار مسطح مثلثی برای یون نیترات (NO₃⁻) می شود. زاویه پیوند O-N-O تقریباً 120 درجه است. اتم هیدروژن به یکی از اتم های اکسیژن متصل شده و ساختار کلی را کمی از حالت کاملاً مسطح خارج می کند اما همچنان تقارن نسبی را حفظ می کند. این هندسه ی مولکولی بر خواص فیزیکی و واکنش پذیری اسید نیتریک تأثیرگذار است. توزیع بار در این ساختار نیز نقش کلیدی دارد.
ساختار رزونانسی یون نیترات (NO₃⁻)
پیوندهای N-O در یون نیترات نه یگانه و نه دوگانه خالص هستند بلکه ترکیبی از هر دو هستند. ساختار واقعی یون میانگینی از سه ساختار رزونانسی است که در آنها پیوند دوگانه بین نیتروژن و هر یک از اتم های اکسیژن به طور متناوب جابجا می شود. این دهیدره شدن بار منفی بر روی سه اتم اکسیژن و پایداری بالای یون نیترات را توجیه می کند. این پایداری نقش کلیدی در واکنش پذیری اسید نیتریک دارد.
خواص فیزیکی مرتبط با ساختار مولکولی
برهم کنش های قوی بین مولکول های اسید نیتریک باعث نقطه جوش بالای آن (83 درجه سانتی گراد) ، چگالی بالای آن (1.51 g/cm³) و فشار بخار نسبتا کم آن می شود. ساختار مسطح و تقارن نسبی آن بر انحلال پذیری بالای آن در آب تاثیر می گذارد. نیروهای بین مولکولی قوی انرژی بیشتری برای تبدیل مایع به بخار نیاز دارند بنابراین نقطه جوش بالا را توجیه می کنند.
اسید نیتریک در واکنش های شیمیایی : ساختار چگونه رفتار را تعیین می کند ؟
قدرت اکسیدکنندگی بالای اسید نیتریک به وجود اتم نیتروژن با عدد اکسایش +5 و سه اتم اکسیژن مرتبط با آن برمی گردد. این ساختار اسید نیتریک را قادر می سازد تا الکترون ها را از مواد دیگر بگیرد و خود به گونه های کاهش یافته تبدیل شود مانند NO₂ یا NO. این ویژگی آن را در واکنش های اکسیداسیون فلزات و ترکیبات آلی بسیار مؤثر می کند. علاوه بر این قابلیت اهدای یون هیدروژن (H⁺) آن را به عنوان یک اسید قوی معرفی می کند که با بازها واکنش می دهد. ساختار مولکولی زمینه ساز این واکنش پذیری بالا است.
اثر ساختار بر خاصیت اکسیدکنندگی اسید نیتریک
قدرت اکسیدکنندگی بالای اسید نیتریک مستقیماً از ساختار مولکولی آن به خصوص وجود اتم نیتروژن با عدد اکسایش +5 و سه اتم اکسیژن پیرامون آن ناشی می شود. نیتروژن در حالت های با عدد اکسایش بالا به دلیل ناپایداری تمایل شدیدی به کاهش عدد اکسایش خود از طریق گرفتن الکترون از مواد دیگر و رسیدن به ترکیبات پایدارتر مانند NO یا NO₂ نشان می دهد. این فرایند اکسیداسیون اسید نیتریک را به عنوان یک عامل اکسیدکننده قوی در بسیاری از واکنش های شیمیایی مطرح می کند. وجود پیوندهای قطبی در مولکول نیز در این قدرت اکسیدکنندگی موثر است.
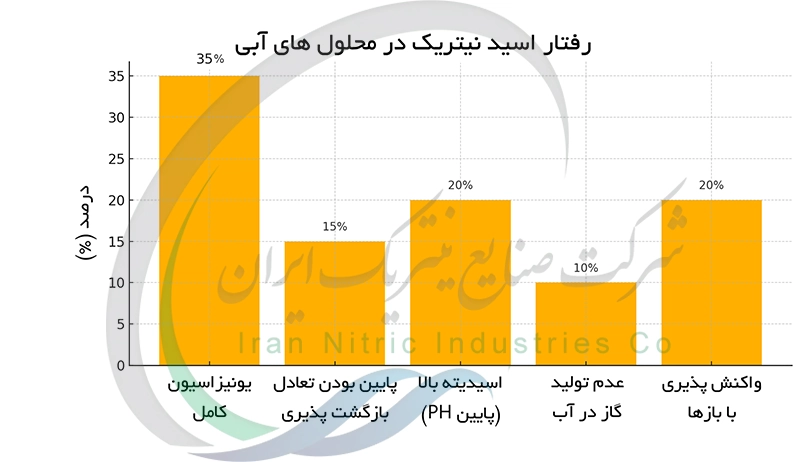
رفتار اسید نیتریک در محلول های آبی
اسید نیتریک در آب به طور کامل تفکیک (یونیزه) می شود و یون های هیدرونیوم (H₃O⁺) و یون های نیترات (NO₃⁻) تولید می کند. این یونیزاسیون کامل به دلیل پیوند هیدروژن-اکسیژن نسبتا ضعیف در گروه -OH اسید نیتریک و پایداری بالای یون نیترات (به دلیل رزونانس) است. یون های هیدرونیوم آزاد شده ، محلول را اسیدی می کنند و باعث ایجاد خاصیت خورندگی بالای محلول اسید نیتریک در آب می شوند. این رفتار اسیدی قوی اسید نیتریک را به عنوان یک الکترولیت قوی طبقه بندی می کند.
مقایسه ساختار اسید نیتریک با سایر اسیدهای معدنی
برخلاف اسیدهای معدنی چند اتمی مانند سولفوریک (H₂SO₄) و فسفریک (H₃PO₄) که ساختارهای پیچیده تری دارند ، اسید نیتریک ساختاری ساده تر با یک اتم نیتروژن مرکزی دارد. این سادگی ظاهری با قدرت اکسیدکنندگی بسیار بالای آن در تضاد است. ساختار ساده تر قابلیت اکسیداسیون بالاتر را نشان می دهد که در مقایسه با اسیدهای دیگری مانند اسید سولفوریک که تمایل کمتری به اکسایش دارند ، کاربردهای متفاوتی را برای اسید نیتریک ایجاد می کند.
تأثیر ساختار بر ذخیره سازی و حمل اسید نیتریک
ساختار مولکولی اسید نیتریک به ویژه قدرت اکسیدکنندگی بالای آن و تمایل به تجزیه ، ذخیره سازی و حمل آن را به چالش می کشد. اسید نیتریک باید در ظروف تیره و از جنس مواد مقاوم به خوردگی (مانند شیشه بوروسیلیکات یا استنلس استیل) نگهداری شود. قرارگیری در معرض نور و گرما می تواند منجر به تجزیه و آزاد شدن گازهای سمی شود. همچنین دقت در نگهداری از آن در زمان خرید اسید نیتریک و حمل آن ، به دور از مواد آلی و احیا کننده ضروری است تا از واکنش های شدید و خطرناک جلوگیری شود.
مدلسازی مولکولی اسید نیتریک با نرم افزارهای شیمیایی
نرم افزارهای شیمیایی پیشرفته مانند Chem3D, GaussView و Avogadro امکان شبیه سازی دقیق ساختار سه بعدی اسید نیتریک شامل طول پیوندها ، زاویه های پیوندی و هندسه مولکولی را فراهم می کنند. این مدل ها نه تنها ساختار مسطح مثلثی یون نیترات را به نمایش می گذارند ، بلکه امکان بررسی دقیق تر پارامترهای هندسی و پتانسیل الکترواستاتیکی مولکول را نیز ارائه می دهند. با استفاده از این نرم افزارها می توان به طور دقیق تر چگونگی برهم کنش های بین مولکولی مانند پیوند هیدروژنی را تجسم و تحلیل کرد و در نتیجه درک عمیق تری از خواص فیزیکی و شیمیایی اسید نیتریک به دست آورد. مدل سازی دینامیک مولکولی نیز امکان بررسی رفتار اسید نیتریک در شرایط مختلف را فراهم می کند.
فرمول مولکولی vs فرمول تجربی : تفاوت ها در اسید نیتریک
برای اسید نیتریک فرمول مولکولی (HNO₃) و فرمول تجربی یکسان هستند. فرمول مولکولی نشان دهنده تعداد و نوع اتم های موجود در یک مولکول است در حالی که فرمول تجربی ساده ترین نسبت اتم های مختلف در یک ترکیب را نشان می دهد. در مواردی که مولکول از واحدهای تکراری تشکیل شده باشد مانند پلیمرها این دو فرمول متفاوت خواهند بود. فرمول تجربی مانند CH در بنزن ساده ترین نسبت اتم های سازنده ی یک ترکیب را نشان می دهد. اما فرمول مولکولی مانند C₆H₆ در بنزن تعداد واقعی اتم های موجود در هر مولکول را مشخص می کند. در اسید نیتریک هم فرمول مولکولی و هم فرمول تجربی HNO₃ است زیرا هر مولکول اسید نیتریک شامل یک اتم هیدروژن ، یک اتم نیتروژن و سه اتم اکسیژن است و هیچ واحد تکراری وجود ندارد.




