فهرست عناوین
- مقدمه
- خواص شیمیایی و گریدهای آزمایشگاهی اسید نیتریک
- کاربردهای عمده اسید نیتریک در آزمایشگاه های تحقیقاتی پزشکی
- هضم نمونه برای آنالیز عنصری (شیمی تجزیه)
- نگهداری نمونه ها برای تحلیل
- کاربردهای آسیب شناسی : کلسیم زدایی از بافت ها
- آزمون ها و واکنش های بیوشیمیایی مرتبط با اسید نیتریک
- آزمون های تشخیصی بالینی با استفاده از اسید نیتریک
- واکنش های نیتراسیون در پژوهش های دارویی
- تهیه معرف ها و ترکیبات نیتراتی
- تمیزکاری و رفع آلودگی تجهیزات آزمایشگاهی
- پروتکل های ایمنی برای کار با اسید نیتریک
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 08-05-1404
تاریخ بروزرسانی مقاله : 08-05-1404
تعداد کلمات : 2400
آدرس مقاله : لینک مقاله
کاربرد اسید نیتریک در آزمایشگاه های تحقیقاتی پزشکی

مقدمه
اسید نیتریک (HNO3) یک اسید معدنی بسیار خورنده و قوی است که به طور گسترده در آزمایشگاه های تحقیقات پزشکی استفاده می شود. این اسید خاصیت اکسیدکنندگی قوی دارند و قادر است طیف وسیعی از مواد را حل کند ، که آن را در بسیاری از پروتکل های آزمایشی بی نهایت ارزشمند ساخته است. از آماده سازی نمونه های زیستی برای آنالیز گرفته تا تمیز کردن تجهیزات آزمایشگاهی ، اسید نیتریک نقش های متعددی در محیط های پژوهشی ایفا می کند.
خواص شیمیایی و گریدهای آزمایشگاهی اسید نیتریک
اسید نیتریک در دمای اتاق مایعی بی رنگ است که نمونه های غلیظ یا کهنه آن به دلیل وجود بخارات دی اکسید نیتروژن به رنگ زرد یا قهوه ای دیده می شوند. این اسید معدنی بسیار قوی با فرمول شیمیایی HNO₃ و جرم مولی حدود ۶۳ گرم بر مول است ، بویی تند دارد و کاملا در آب حل می شود. در آزمایشگاه معمولا اسید نیتریک با غلظت ۶۸ تا ۷۰ درصد (گرید معرف) استفاده می شود. محلول هایی با غلظت بالاتر از ۸۶ درصد دودکننده هستند و بخارات قهوه ای مایل به قرمز NO₂ از آن ها متصاعد می شود. اسید نیتریک عامل اکسیدکننده بسیار قوی بوده و قادر است فلزات و بسیاری از ترکیبات آلی را به شدت اکسید کند. به دلیل واکنش پذیری بالا و سمیت گازهای تولیدی ، هنگام کار با آن باید احتیاط زیادی به خرج داد و از گریدهای خالص برای آزمایش های دقیق استفاده کرد.
کاربردهای عمده اسید نیتریک در آزمایشگاه های تحقیقاتی پزشکی
همه کاره بودن اسید نیتریک باعث شده در طیف گسترده ای از تکنیک ها و فرآیندهای آزمایشگاهی مورد استفاده قرار گیرد. از شیمی تجزیه و آماده سازی نمونه گرفته تا فرآوری بافت شناسی ، آزمون های بیوشیمی و حتی نگهداری تجهیزات رد پای این اسید در بسیاری از فعالیت های پژوهشی دیده می شود. در زیر خلاصه ای از مهم ترین کاربردهای اسید نیتریک در آزمایشگاه های تحقیقاتی پزشکی به همراه هدف و احتیاطات مرتبط با هر مورد ارائه شده است.
| حوزه کاربرد | کاربرد مشخص | غلظت یا روش معمول | هدف/نتیجه | احتیاطات/نکات |
|---|---|---|---|---|
| شیمی تجزیه | هضم نمونه برای آنالیز فلزات (ICP-MS، AAS) | اسید نیتریک غلیظ (~۷۰٪)، اغلب با حرارت | حل کردن بافت های زیستی و آزادسازی عناصر کم مقدار برای اندازه گیری دقیق | استفاده از اسید بسیار خالص برای جلوگیری از آلودگی؛ انجام هضم زیر هود به دلیل بخارات سمی |
| شیمی تجزیه | نگهداری نمونه های آبی/زیستی برای آزمون ها | افزودن اسید نیتریک رقیق (۱ تا ۲٪ حجمی به نمونه) | اسیدی کردن و پایدارسازی نمونه ها، جلوگیری از رسوب فلزات یا رشد میکروبی | نگهداری نمونه های اسیددار در ظروف مناسب؛ برچسب گذاری به عنوان ماده خورنده |
| آسیبشناسی بافتی | کلسیمزدایی (زدودن کلسیم) از بافتها (مثلاً نمونههای استخوان) | اسید نیتریک رقیق (۵ تا ۱۰٪) | حذف رسوبات معدنی (کلسیم) از بافت استخوان برای امکان برشگیری و میکروسکوپی | محدود کردن زمان قرارگیری بافت در اسید برای جلوگیری از آسیب؛ شستشوی کامل پس از کلسیمزدایی |
| بیوشیمی | آزمونهای تشخیص پروتئین (آزمایش زانتوپروتئیک) | اسید نیتریک غلیظ (واکنش با نمونه) و سپس افزودن قلیا | شناسایی اسیدهای آمینه آروماتیک در پروتئینها از طریق تغییر رنگ زرد (و سپس نارنجی) | احتیاط در کار با اسید برای جلوگیری از تماس با پوست (میتواند پوست را زرد کند)؛ انجام آزمایش در هود |
| تشخیص بالینی | آزمایشهای کیفی ادرار (آزمایش حلقه هلر برای پروتئین، آزمایش گملین برای صفرا) | اسید نیتریک غلیظ به صورت لایهبندیشده زیر یا مخلوط با نمونه ادرار | ایجاد واکنش قابل مشاهده (حلقه سفید برای پروتئین، حلقههای رنگی برای رنگدانههای صفرا) که وجود برخی ترکیبات در نمونه بالینی را نشان میدهد | دقت در لایهبندی اسید (چگالی آن از ادرار بیشتر است)؛ انجام این آزمایشهای کلاسیک با تجهیزات ایمنی و دفع صحیح مواد |
| سنتز آلی | نیتراسیون ترکیبات (پژوهش دارویی) | مخلوط اسیدها (نیتریک + سولفوریک) برای تولید یون نیترونیوم | وارد کردن گروه نیترو به مولکولهای آلی (مثلاً سنتز واسطههای دارویی مانند نیتروگلیسیرین یا رنگها) | کنترل دقیق دما برای جلوگیری از واکنشهای خارج از کنترل؛ انجام نیتراسیون در مقیاس کم و با حفاظ مناسب |
| تهیه معرفهای شیمیایی | تولید نمکهای نیترات (مثلاً نیترات نقره) | واکنش اسید نیتریک با فلزات یا بازها (خنثیسازی) | تولید معرفهای مهم آزمایشگاهی و ترکیبات دارویی (نیترات نقره, نیترات پتاسیم و غیره) | انجام واکنشها در محیط دارای تهویه؛ توجه به انتشار گازهای سمی (اکسیدهای نیتروژن) در طی حل کردن فلزات |
| نگهداری تجهیزات | تمیز کردن و رفع آلودگی دستگاهها و ظروف آزمایشگاهی | شستشو با اسید نیتریک غلیظ یا غوطهوری در تیزاب سلطانی (اسید نیتریک + HCl) | زدودن باقیماندههای آلی و فلزی؛ بازگرداندن شیشهآلات و ابزار به حالت تمیز | استفاده حتمی از تجهیزات حفاظتی؛ شستشوی کامل پس از تمیزکاری با اسید؛ هرگز مخلوط کردن با مواد آلی خارج از رویههای کنترلشده |
هضم نمونه برای آنالیز عنصری (شیمی تجزیه)
یکی از کاربردهای مهم اسید نیتریک در پژوهش های پزشکی ، هضم نمونه ها برای آنالیز عناصر معدنی در نمونه های زیستی مانند خون ، ادرار و بافت ها است. این روش برای مطالعات سم شناسی (سرب ، آرسنیک) و تغذیه ای (آهن ، روی) کاربرد دارد. اسید نیتریک با حرارت دادن نمونه ها ، مواد آلی را تجزیه و یون های فلزی را آزاد کرده و محلولی شفاف مناسب برای آنالیز ایجاد می کند. محلول به دست آمده برای روش های تحلیلی پیشرفته نظیر ICP-MS، ICP-OES و AAS مناسب است و نتایج دقیقی فراهم می کند. در این فرایند نمک های نیترات تشکیل شده معمولا مزاحمتی برای اندازه گیری ایجاد نمی کنند. آزمایشگاه ها از اسید نیتریک فوق خالص استفاده می کنند تا از آلودگی فلزی جلوگیری شده و دقت آنالیز حفظ شود. این روش برای تشخیص مسمومیت ها و بررسی کمبود عناصر معدنی در بدن ضروری است.
نگهداری نمونه ها برای تحلیل
در آزمایشگاه های پژوهشی پزشکی و محیطی اسید نیتریک برای حفظ و نگهداری نمونه های مایع مانند آب ، ادرار یا عصاره ها قبل از آنالیز استفاده می شود. افزودن مقدار اندکی اسید نیتریک (معمولا کمتر از ۱٪ حجم نمونه) دو هدف مهم دارد : نخست جلوگیری از رسوب یون های فلزی در pH خنثی یا قلیایی و دوم مهار رشد میکروبی. با کاهش pH نمونه به زیر ۲ ، فلزات به شکل یونی و محلول باقی مانده و از تغییرات شیمیایی ناخواسته جلوگیری می شود. این روش برای نمونه هایی که برای مدتی طولانی نگهداری می شوند (مثل آزمایش سرب در آب آشامیدنی یا نمونه های زیستی پزشکی) بسیار حیاتی است. ظروف حاوی نمونه های اسیددار باید برچسب مشخص داشته و به عنوان مواد خورنده جابه جا شوند تا ایمنی کارکنان حفظ شود و نمونه ها تا زمان آنالیز به حالت اصلی خود باقی بمانند.
کاربردهای آسیب شناسی : کلسیم زدایی از بافت ها
در آزمایشگاه های آسیب شناسی و بافت شناسی ، خرید اسید نیتریک شیراز بشکه 220 لیتری به طور گسترده برای کلسیم زدایی (دکلسیفیکاسیون) نمونه های بافتی سخت مثل استخوان ها ، دندان ها و رسوبات کلسیومی استفاده می شود. برای اینکه نمونه های استخوانی جهت مطالعه میکروسکوپی برش پذیر شوند ، ابتدا باید بخش معدنی آنها (عمدتا نمک های کلسیم) حذف گردد. این کار توسط محلول رقیق اسید نیتریک (۵٪ تا ۱۰٪) انجام می گیرد که می تواند مواد معدنی مانند فسفات کلسیم را به سرعت حل کند. سرعت عمل اسید نیتریک مزیت اصلی آن نسبت به عوامل کلسیم زدای ملایم تر مانند EDTA است. به طوری که کلسیم زدایی نمونه های کوچک استخوانی طی چند ساعت تا چند روز انجام می شود در حالی که با EDTA ممکن است چندین هفته زمان ببرد. با این حال خاصیت تهاجمی این اسید در صورت استفاده بیش از حد ممکن است باعث تخریب جزئیات سلولی و اختلال در رنگ آمیزی های بعدی گردد. به همین دلیل در پروتکل های آزمایشگاهی زمان و غلظت اسید نیتریک با دقت کنترل شده و نمونه پس از کلسیم زدایی کاملا شسته می شود تا از آسیب به بافت جلوگیری شود.
آزمون ها و واکنش های بیوشیمیایی مرتبط با اسید نیتریک
اسید نیتریک در بسیاری از آزمون های بیوشیمیایی کلاسیک کاربرد دارد. آزمون معروف زانتوپروتئیک نمونه ای از این کاربرد است که برای تشخیص پروتئین ها استفاده می شود. در این تست ، اسید نیتریک غلیظ با اسیدهای آمینه آروماتیک موجود در پروتئین ها مانند تیروزین و تریپتوفان واکنش داده و محصولی زردرنگ ایجاد می کند. افزودن آمونیاک به مخلوط باعث تغییر رنگ به نارنجی شده و وجود این نوع پروتئین ها را تایید می کند. همین واکنش دلیل زرد شدن پوست انسان در تماس با اسید نیتریک است. یک آزمون کلاسیک دیگر تست مورکسید برای تشخیص اسید اوریک است. در این آزمون نمونه ای که احتمالا حاوی اسید اوریک است با اسید نیتریک حرارت داده شده و سپس خشک می شود. افزودن قطره ای آمونیاک به آن باعث ایجاد رنگ ارغوانی (مورکسید) می شود که نشانه حضور اسید اوریک است. اگرچه امروزه روش های مدرن تر جایگزین شده اند ، این آزمون ها همچنان مبنایی مهم در آموزش و پژوهش بیوشیمی محسوب می شوند.
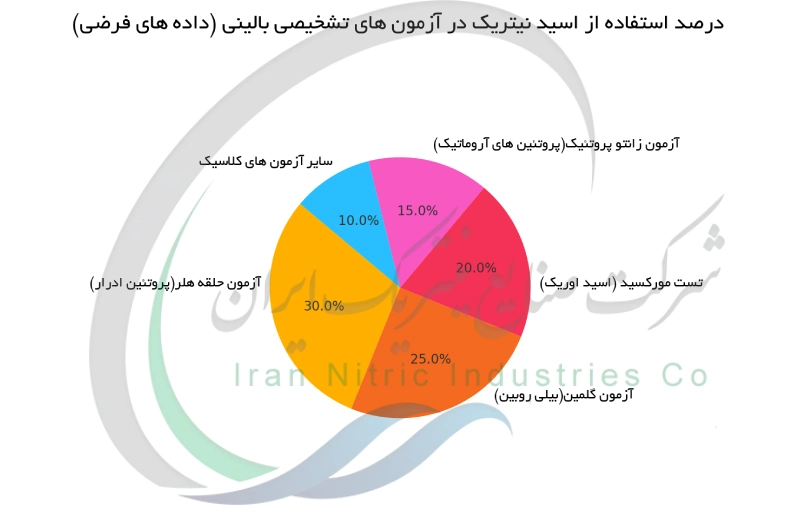
آزمون های تشخیصی بالینی با استفاده از اسید نیتریک
اسید نیتریک به دلیل ویژگیهای شیمیایی خاص خود در گذشته در چندین آزمون بالینی ساده برای تشخیص مواد خاص در نمونه های ادراری به کار می رفت. آزمون حلقه هلر نمونه ای از این کاربرد است. در این روش اسید نیتریک غلیظ به آرامی زیر نمونه ادرار ریخته می شود و در صورت حضور پروتئین ، یک حلقه سفید از پروتئین دناتوره شده در مرز دو لایه ظاهر می گردد که به صورت بصری پروتئینوری (وجود پروتئین در ادرار) را نشان می دهد. یک آزمون معروف دیگر تست گملین است که برای تشخیص بیلی روبین (رنگدانه صفراوی) به کار می رود. در این آزمون اسید نیتریک دودکننده با ادرار حاوی بیلی روبین واکنش داده و در محل تماس دو لایه مجموعه ای از رنگ های مختلف (سبز ، آبی ، بنفش ، قرمز) ایجاد می کند. اگرچه امروزه این آزمون ها بیشتر اهمیت تاریخی و آموزشی دارند و جایگزین های مدرن تری برای آن ها استفاده می شود اما اصول شیمیایی زیربنایی آن ها همچنان برای درک روش های تشخیصی امروزی مفید است. این نمودار دایره ای درصد تقریبی استفاده از اسید نیتریک در آزمون های تشخیصی بالینی کلاسیک را نشان می دهد.
واکنش های نیتراسیون در پژوهش های دارویی
اسید نیتریک به دلیل توانایی ایجاد یون نیترونیوم (NO₂⁺) ، نقش مهمی در واکنش های نیتراسیون در شیمی آلی و پژوهش های دارویی دارد. نیتراسیون شامل اضافه کردن یک گروه نیترو (-NO₂) به مولکول های آلی به خصوص ترکیبات آروماتیک است و معمولا با استفاده از مخلوط اسید نیتریک و اسید سولفوریک انجام می شود. این واکنش ها در سنتز حد واسطهای دارویی و ترکیبات زیستی کاربرد دارند. نمونه برجسته آن تولید نیتروگلیسیرین از گلیسرول است که هم به عنوان ماده منفجره و هم به عنوان گشادکننده عروق در درمان آنژین صدری استفاده می شود. همچنین نیتراسیون بنزن برای تولید نیتروبنزن ، پیش ساز آنیلین (ماده اولیه بسیاری از داروها و رنگ ها) از دیگر کاربردهای مهم آن است. این واکنش ها به شدت گرمازا بوده و به کنترل دقیق شرایط آزمایشگاهی نیاز دارند تا خطر واکنش کنترل نشده و انفجار کاهش یابد. بنابراین اسید نیتریک در تحقیقات دارویی و سنتز ترکیبات جدید بسیار ارزشمند است.
تهیه معرف ها و ترکیبات نیتراتی
اسید نیتریک علاوه بر نیتره کردن مولکول های آلی در تهیه انواع نمک های نیترات معدنی نیز کاربرد دارد. این نمک ها در آزمایشگاه ها و پزشکی به عنوان معرف های مهم استفاده می شوند. مثلا از واکنش اسید نیتریک با نقره ، نیترات نقره به دست می آید که در شیمی تجزیه برای شناسایی یون کلرید و در پزشکی برای ضدعفونی و سوزاندن زخم کاربرد دارد. نیترات پتاسیم نیز با واکنش اسید نیتریک و پتاس تولید می شود و در ترکیبات ادرارآور و خمیر دندان ضدحساسیت به کار رفته است. نیترات آمونیوم تولید شده از آمونیاک و اسید نیتریک کاربرد وسیعی به عنوان کود شیمیایی و منبع نیتروژن دارد. همچنین تولید استرهای نیتریک مانند نیتروسلولز (حاصل از واکنش سلولز با اسید نیتریک و سولفوریک) نیز اهمیت ویژه ای دارد. نیتروسلولز در تولید بانداژ ، کولودیون و صافی های آزمایشگاهی استفاده شده است. بنابراین واکنش پذیری بالای اسید نیتریک باعث تولید ترکیباتی ارزشمند برای کاربردهای آزمایشگاهی و پزشکی می شود.
تمیزکاری و رفع آلودگی تجهیزات آزمایشگاهی
در آزمایشگاه های پژوهشی پزشکی اسید نیتریک به طور گسترده ای برای تمیز کردن و رفع آلودگی شیشهآلات و تجهیزات به کار می رود تا از آلودگی فلزی جلوگیری شده و دقت آزمایش ها حفظ شود. به ویژه در آزمایش هایی که عناصر جزئی آنالیز می شوند ، ظروف آزمایشگاهی در حمام اسید نیتریک رقیق شستشو داده می شوند تا یون های فلزی از سطح آن ها حذف شده و هرگونه آلودگی رفع گردد. همچنین اسید نیتریک همراه با اسید هیدروکلریک ، تیزاب سلطانی را تشکیل می دهد که به عنوان محلولی بسیار قدرتمند برای تمیز کردن لوله های NMR ، بوته های آزمایشگاهی و قطعات آلوده به فلزات نجیب (مانند طلا یا پلاتین) و رسوبات آلی استفاده می شود. علاوه بر این اسید نیتریک برای پسیو کردن سطوح فولاد زنگ نزن کاربرد دارد. این فرایند شامل حذف آهن سطحی و تشکیل لایه اکسید کروم محافظ برای افزایش مقاومت به خوردگی تجهیزات پزشکی و آزمایشگاهی است. پس از این فرآیندها تجهیزات باید کاملا با آب یون زدوده آبکشی شوند تا بقایای اسید تداخل یا خوردگی ایجاد نکند.
پروتکل های ایمنی برای کار با اسید نیتریک
کار با اسید نیتریک به دلیل خاصیت خورنده ، سمیت و واکنش پذیری بالا نیازمند رعایت پروتکل های ایمنی دقیق است. کارکنان آزمایشگاه باید آموزش های لازم را دریافت کرده و حتما از تجهیزات محافظ شخصی (PPE) شامل دستکش مقاوم در برابر مواد شیمیایی ، روپوش آزمایشگاهی یا پیش بند ضد اسید و عینک ایمنی یا محافظ صورت استفاده کنند. به دلیل تحریک کنندگی شدید بخارات اسید نیتریک برای دستگاه تنفسی کار باید همواره زیر هود انجام شود تا از استنشاق این بخارات جلوگیری گردد. هرگز مستقیما بالای ظرف حاوی اسید بو نکشید زیرا حتی تماس کوتاه نیز ممکن است باعث سرفه و سوزش گلو شود. برای جلوگیری از پاشش و سوختگی های شدید ، انتقال و رقیق سازی اسید باید به آرامی و با ابزارهای مخصوص انجام گیرد. در زمان رقیق سازی همیشه باید اسید را به آرامی به آب اضافه کرد و نه برعکس ، زیرا افزودن آب به اسید غلیظ می تواند باعث واکنش گرمازای شدید و خطرناک شود. امکانات اضطراری مانند دوش و چشم شوی ایمنی باید در نزدیکی محل کار موجود باشند تا در صورت تماس تصادفی با اسید منطقه آلوده سریعا به مدت حداقل ۱۵ دقیقه با آب فراوان شسته شده و در صورت ضرورت به خدمات پزشکی مراجعه شود. لکه های زرد ایجاد شده روی پوست نشانه واضحی از تماس با اسید نیتریک است. علاوه بر این اسید نیتریک باید از مواد ناسازگار مانند حلال های آلی ، عوامل کاهنده و فلزات واکنش پذیر (مثل آلومینیوم پودری) دور نگه داشته شود ، زیرا مخلوط شدن با این مواد می تواند خطر آتش سوزی یا انفجار را ایجاد کند. پژوهشگران معمولا اسید نیتریک را به تدریج و در مقادیر کم استفاده می کنند تا واکنش تحت کنترل باشد. تمام روش هایی که از این اسید استفاده می کنند باید دارای دستورالعمل عملیاتی استاندارد (SOP) بوده و پسماندهای تولید شده نیز به طور اصولی مدیریت شوند.




