فهرست عناوین
- مقدمه
- تولید صنعتی اسید نیتریک (فرایند استوالد)
- نقش اسید نیتریک در تولید کود
- اسید نیتریک در مواد منفجره و ترکیبات پرانرژی
- اسید نیتریک در پیشرانه های راکتی و فضاپیماها
- اسید نیتریک در تولید پلیمرها و نایلون
- اسید نیتریک در سنتزهای شیمیایی و واکنش های نیتره کردن
- اسید نیتریک در متالورژی و بهسازی سطح فلزات
- اسید نیتریک در ساخت نیمه هادی ها و الکترونیک
- اسید نیتریک در کاربردهای آزمایشگاهی و تحلیلی
- اسید نیتریک در نانوفناوری و مواد پیشرفته
- اسید نیتریک در بازیافت سوخت هسته ای
- کاربردهای کلیدی اسید نیتریک در یک نگاه
نوشته شده توسط شرکت صنایع نیتریک ایران
منتشر شده توسط شرکت صنایع نیتریک ایران
تاریخ انتشار مقاله : 06-10-1404
تاریخ بروزرسانی مقاله : 06-10-1404
تعداد کلمات : 3400
آدرس مقاله : لینک مقاله
استفاده از اسید نیتریک در فناوری های مدرن

مقدمه
اسید نیتریک (HNO3) یکی از مهم ترین ماده شیمیایی در صنعت مدرن است و به داشتن طبیعت بسیار خورنده و خواص اکسیدکنندگی قوی شناخته می شود. این اسید معدنی از اوایل قرن بیستم سنگ بنای شیمی صنعتی بوده و همچنان پشتیبان بسیاری از فناوری های امروزی است. از تولید انبوه کودهای شیمیایی که کشاورزی جهانی را سرپا نگه می دارد تا ساخت وسایل الکترونیکی پیشرفته، واکنش پذیری متنوع اسید نیتریک آن را به ماده ای حیاتی و غیر قابل جایگزین تبدیل کرده است. در چنین بازاری، موضوع خرید حواله اسید نیتریک کارون برای صنایع مصرف کننده اهمیت ویژه ای پیدا می کند، زیرا دسترسی پایدار به این ماده نقش مستقیمی در تداوم تولید دارد. این ماده هم به عنوان یک اسید قوی و هم به عنوان منبعی برای عامل های نیتراته کننده و اکسیدکننده عمل می کند و انجام تبدیلات شیمیایی را ممکن می سازد که در غیر این صورت دشوار یا غیرممکن بودند. هر سال ده ها میلیون تن اسید نیتریک در سراسر جهان تولید می شود تا نیاز بخش های مختلف را برآورده کند.
تولید صنعتی اسید نیتریک (فرایند استوالد)
صنایع مدرن عمدتاً از فرایند استوالد برای تولید اسید نیتریک در مقیاس صنعتی استفاده می کنند؛ این روش در اوایل دهه 1900 توسط ویلهلم استوالد توسعه یافت و هنوز هم روش استاندارد امروز است. در این فرایند، گاز آمونیاک (NH3) با عبور از روی کاتالیزور داغ پلاتین-رودیوم اکسید شده و مونوکسید نیتروژن (NO) تشکیل می دهد؛ سپس NO در حضور اکسیژن به دی اکسید نیتروژن (NO2) تبدیل می شود. گاز NO2 در آب جذب می شود تا اسید نیتریک حاصل گردد. این تبدیل شیمیایی چندمرحله ای به طور کارآمدی نیتروژن هوا (از طریق آمونیاک) را به شکل اسیدی قابل استفاده تثبیت می کند. واکنش های دمای بالای این فرایند نیازمند کنترل دقیق دما، فشار و شرایط کاتالیست است تا بازده بالا و حداقل محصولات جانبی حاصل شود. کارخانجات مدرن تولید اسید نیتریک اغلب با واحدهای تولید آمونیاک یکپارچه شده اند تا بهره وری بهبود یافته و نیاز به حمل و نقل کاهش یابد. فرایند استوالد بسیار کارآمد است و به جز انتشار گازهای خروجی که معمولاً تصفیه می شوند ضایعات نسبتاً کمی تولید می کند. با بهبود مداوم طراحی کاتالیست و بهینه سازی فرایند، صنایع قادرند اسید نیتریک را در مقیاس عظیم تولید کنند. در دسترس بودن گسترده اسید نیتریک ارزان قیمت یک عامل کلیدی بوده است که استفاده وسیع از آن را در حوزه های مختلف فناوری ممکن ساخته است.
نقش اسید نیتریک در تولید کود
یکی از حیاتی ترین کاربردهای اسید نیتریک امروز، تولید کودهای ازته است که تامین کننده غذای جمعیت جهانی هستند. در این صنعت، اسید نیتریک را با آمونیاک (که آن هم از طریق فرایند هابر تولید می شود) واکنش می دهند تا نیترات آمونیوم (NH4NO3) حاصل شود؛ این ماده یک کود غنی از نیتروژن است که گیاهان برای رشد به آن نیاز دارند. این واکنش خنثی سازی ساده که در مقیاسی عظیم انجام می شود، بیشترین بخش اسید نیتریک تولیدی را مصرف می کند. نیترات آمونیوم می تواند مستقیماً به عنوان کود استفاده شود یا در ترکیب با مواد دیگر به صورت کودهای کلسیم آمونیوم نیترات یا محلول های اوره-آمونیوم نیترات برای کاربردهای کشاورزی درآید. با فراهم ساختن امکان تولید انبوه این کودها، اسید نیتریک نقشی مستقیم در افزایش عملکرد محصولات کشاورزی و تداوم رشد جمعیت جهان ایفا کرده است. کارخانه های مدرن کودسازی اغلب واحد تولید اسید نیتریک را در محل خود دارند تا تامین پیوسته اسید برای تولید نیترات ها تضمین شود. همچنین از اسید نیتریک در فرایند نیتروفسفات برای تولید کودهای ترکیبی NPK از طریق حل کردن سنگ فسفات استفاده می شود. به طور کلی، نقش اسید نیتریک در صنعت کود پایه ای است این ماده امکان تبدیل نیتروژن غیرفعال هوا به شکل قابل جذب برای گیاهان را در مقیاسی فراهم کرده است که زیربنای کشاورزی مدرن محسوب می شود.
اسید نیتریک در مواد منفجره و ترکیبات پرانرژی
یکی دیگر از کاربردهای عمده اسید نیتریک در صنعت مواد منفجره است، جایی که این اسید نقش کلیدی در ایجاد مواد پرانرژی ایفا می کنند. بسیاری از مواد منفجره قوی از طریق واکنش نیتره کردن افزودن گروه های نیترو (-NO2) به مولکول های آلی با استفاده از ترکیب اسید نیتریک و اسید سولفوریک به دست می آیند. به عنوان مثال، تری نیتروتولوئن (TNT) از نیتره کردن مرحله به مرحله تولوئن توسط اسید نیتریک تولید می شود. نیتروگلیسیرین، یک ماده منفجره و پیشرانه قوی, با نیتره کردن گلیسرول توسط مخلوط اسید نیتریک و سولفوریک ساخته می شود. به همین ترتیب، ترکیباتی مثل RDX و PETN که در مواد منفجره نظامی و صنعتی به کار می روند، از طریق شیمی نیتراته مبتنی بر اسید نیتریک سنتز می شوند، به طوری که نقش اسید نیتریک در جنگ های جهانی به عنوان یکی از پایه های اصلی تولید مهمات و مواد انفجاری کاملا برجسته و تعیین کننده بود. حتی خود نیترات آمونیوم همان کود شیمیایی حاصل از اسید نیتریک نیز به عنوان جزء انفجاری مانند ANFO، که همان نیترات آمونیوم با سوخت نفتی است به طور گسترده در معادن و پروژه های ساختمانی استفاده می شود. توانایی اسید نیتریک در ایجاد این ترکیبات غنی از نیتروژن زیربنای تولید مواد انفجاری، مهمات و پیشرانه ها را تشکیل می دهد. این نقش اسید نیتریک نه تنها از نظر نظامی اهمیت دارد، بلکه کاربردهای حیاتی غیرنظامی مانند عملیات معدنکاری و توسعه زیرساخت ها را نیز ممکن ساخته است که در آن ها انفجارهای کنترل شده برای شکستن سنگ و استخراج منابع استفاده می شود.
اسید نیتریک در پیشرانه های راکتی و فضاپیماها
اسید نیتریک همچنین به عنوان یک اکسیدکننده قوی در پیشرانه های مایع موشک استفاده شده است، به ویژه در برنامه های اولیه فضایی و موشک های نظامی. اسید نیتریک غلیظ اغلب به صورت اسید نیتریک دودکننده قرمز (RFNA) یا نوع مهار شده آن (که با مقدار کمی HF برای کاهش خورندگی ترکیب شده است با سوخت هایی مانند نفت سفید، هیدرازین یا UDMH (دی متیل هیدرازین نامتقارن) ترکیب می شد تا ترکیب های پیشرانه های هایپرگل ایجاد شود. هایپرگل به این معنی است که سوخت و اکسیدکننده با تماس مستقیم مشتعل می شوند، که مزیت آن ساده سازی طراحی موتور موشک و تضمین احتراق مطمئن در فضا بود. اکسیدکننده های مبتنی بر اسید نیتریک در دمای محیط پایدار هستند و قابلیت ذخیره طولانی مدت دارند، که در برخی کاربردها نسبت به اکسیدکننده های برودتی مانند اکسیژن مایع برتری داشت. در دوره جنگ سرد، بسیاری از موشک های بالستیک و وسایل پرتاب مداری از ترکیبات اکسیدکننده اسید نیتریک استفاده می کردند. به عنوان نمونه، ماهواره بر کاسموس-3M شوروی و چندین موشک قاره پیمای دیگر از اکسیدکننده های مبتنی بر اسید نیتریک بهره می بردند. با این حال به دلیل ماهیت بسیار خورنده و سمی اسید نیتریک، در صنعت موشک سازی مدرن تا حد زیادی توسط تتراکسید دی نیتروژن و دیگر اکسیدکننده های کم واکنش تر جایگزین شده است. با این وجود، نقش آن در پیشبرد تلاش های اولیه بشر برای فراتر رفتن از جو زمین قابل توجه بوده و در تکامل فناوری موشکی تاثیرگذار بوده است.
اسید نیتریک در تولید پلیمرها و نایلون
اسید نیتریک در تولید چندین پلیمر مهم و پیش سازهای آن ها نقش عمیقی دارد. یک مثال بارز، تولید اسید آدیپیک است که ماده اولیه کلیدی نایلون-6،6 محسوب می شود. اسید آدیپیک در مقیاس بزرگ با اکسیداسیون مخلوط سیکلوهگزانون/سیکلوهگزانول توسط اسید نیتریک تولید می شود؛ این فرایند در حال حاضر بخش اعظم تولید جهانی اسید آدیپیک را تشکیل می دهد. این مرحله اکسیداسیون توسط اسید نیتریک برای زنجیره تولید نایلون حیاتی است پس از به دست آمدن اسید آدیپیک، آن را با هگزا متیلن دی آمین ترکیب می کنند تا الیاف پلیمری نایلون ساخته شود که در بی شمار محصول (از منسوجات گرفته تا پلاستیک های مهندسی) کاربرد دارند. یکی دیگر از پلیمرهای تاریخی که به کمک اسید نیتریک ممکن شد، نیتروسلولز (سلولز نیتراته) است. با تیمار سلولز گیاهی (مانند پنبه) توسط اسید نیتریک (همراه با اسید سولفوریک)، شیمیدانان در قرن نوزدهم نیتروسلولز را ساختند؛ این ماده به اولین پلاستیک مصنوعی جهان (با نام تجاری سلولوئید) تبدیل شد و همچنین به عنوان پایه فیلم عکاسی و ماده پیشران در باروت های بی دود به کار رفت. علاوه بر این، شیمی نیتره کردن با استفاده از اسید نیتریک برای ساخت سایر پیش ماده های پلیمری نیز به کار گرفته می شود؛ برای مثال نیتره کردن تولوئن، دی نیتروتولوئن تولید می کند که با هیدروژن دار شدن به تولوئن دی آمین تبدیل می شود ماده اولیه فوم های پلی اورتان. از طریق این مسیرها، اسید نیتریک به شکل گیری صنایع مدرن پلاستیک و الیاف مصنوعی کمک کرده است.
اسید نیتریک در سنتزهای شیمیایی و واکنش های نیتره کردن
علاوه بر کاربردهای حجیم در تولید کود و پلیمر، اسید نیتریک به عنوان یک واکنشگر حیاتی برای سنتز طیف گسترده ای از مواد شیمیایی از طریق واکنش های نیتره کردن و اکسیداسیون عمل می کند. به عنوان مثال در صنعت رنگ و رنگدانه، نیتره کردن آروماتیک ها با اسید نیتریک یک مرحله کلیدی در تولید واسطه های نیتروآروماتیک است که سپس با کاهش به آمین هایی (مانند آنیلین) تبدیل می شوند و برای ساخت رنگ های آزو و رنگدانه ها به کار می روند. صنعت داروسازی نیز از شیمی اسید نیتریک بهره می گیرد: برخی داروها و پیش ماده های آن ها از طریق مراحل نیتره کردن تولید می شوند. برای مثال، سنتز برخی مسکن ها و عوامل ضدباکتریایی شامل افزودن گروه های نیترو به یک حلقه آروماتیک و سپس تبدیل آن ها به گروه های عاملی مورد نیاز داروی فعال است. نقش اسید نیتریک به عنوان عامل نیتره کننده معمولاً با همراهی اسید سولفوریک برای تولید یون نیترونیوم (NO2^+) انجام می شود؛ این یون به صورت الکتروفیلی به مولکول های آلی حمله می کند. علاوه بر این، اسید نیتریک به تولید انواع نمک های نیتراتی و ترکیبات معدنی مورد استفاده در پزشکی و صنعت کمک می کند. نیترات نقره (که از واکنش نقره با اسید نیتریک به دست می آید) یک ترکیب کلاسیک است که به عنوان ضدعفونی کننده و در آنالیزهای آزمایشگاهی کاربرد دارد. در مجموع اسید نیتریک امکان تولید بسیاری از مواد شیمیایی خاص از رنگ های مصنوعی گرفته تا مواد موثره دارویی را فراهم کرده و گواهی بر تطبیق پذیری آن در سنتز شیمیایی است.
اسید نیتریک در متالورژی و بهسازی سطح فلزات
صنایع متالورژی از اسید نیتریک برای هم تمیزکاری و هم تصفیه فلزات استفاده می کنند و از توان خورندگی و اکسیدکنندگی آن بهره می برند. یکی از کاربردهای رایج، اسیدشویی (پیکلینگ) و پسیو کردن فولاد زنگ نزن و سایر آلیاژها است. پس از ساخت یا عملیات حرارتی، فلزات اغلب لایه های اکسید و پوسته دارند؛ غوطه ور کردن آن ها در محلول های اسید نیتریک رقیق یا مخلوط های حاوی اسید نیتریک به حل شدن این اکسیدها کمک می کند و سطح فلز را تمیز و براق می سازد. در مورد فولاد زنگ نزن، اسید نیتریک نه تنها ناخالصی ها را برطرف می کند بلکه به تشکیل یک لایه نازک اکسید کروم محافظ (پسیو) نیز کمک می کند که مقاومت فلز در برابر خوردگی را افزایش می دهد. اسید نیتریک همچنین در تصفیه فلزات گرانبها و غیرگرانبها به کار می رود. به عنوان مثال، در پالایش طلا، اسید نیتریک می تواند نقره و فلزات پایه را در آلیاژهای طلای ناخالص حل کند (فرایندی که جداسازی نام دارد) و در نتیجه طلای تقریباً خالص باقی می ماند. زرگران و بازیافت کنندگان فلزات نیز به طور مشابه از آزمون اسید نیتریک برای سنجش خلوص طلا استفاده می کنند، زیرا اسید به راحتی فلزات کم ارزش تر را حل می کند اما به طلای با عیار بالا حمله نمی کند. این کاربردها نشان می دهند که چگونه خوردگی کنترل شده توسط اسید نیتریک به ابزاری مفید برای بهبود کیفیت و عملکرد فلزات در فناوری مدرن تبدیل شده است.
اسید نیتریک در ساخت نیمه هادی ها و الکترونیک
اسید نیتریک فوق خالص یک ماده شیمیایی اساسی در تولید وسایل الکترونیکی مدرن است، جایی که حتی ناخالصی های ردپایی می توانند ریزمدارها را خراب کنند. در ساخت نیمه هادی ها، اسید نیتریک در مراحل مختلف اچ کاری و تمیزکاری تر به کار می رود. برای مثال، در فرآیند پردازش ویفر سیلیکون، مخلوط های اسید نیتریک، اسید هیدروفلوئوریک (HF) و اسید استیک که به اچ کننده HNA معروف است برای بافت دهی یا اچ کردن سطوح سیلیکونی به صورت کنترل شده استفاده می شوند. اسید نیتریک سطح سیلیکون را به دی اکسید سیلیکون اکسید می کند و سپس HF آن اکسید را حل می کند و در نتیجه سطح سیلیکون تمیز و صاف باقی می ماند. قدرت اکسیدکنندگی بالای اسید نیتریک همچنین برای از بین بردن باقی مانده های آلی (مانند فتورزیست) و حل کردن آلودگی های فلزی روی ویفرها به کار می رود؛ این اسید آلاینده های فلزی را به شکل های محلول اکسید می کند تا بتوان آن ها را شستشو داد. صنعت ساخت برد مدار چاپی (PCB) نیز به طور مشابه در برخی مراحل تمیزکاری و میکرو-اچ از اسید نیتریک استفاده می کند تا سطوح مس را برای لحیم کاری یا آبکاری آماده کند. به دلیل این کاربردها، شرکت های الکترونیکی نیاز به اسید نیتریک گرید الکترونیک با خلوص بسیار بالا دارند (حاوی مقادیر ناچیز یون های فلزی یا ذرات). استفاده از چنین اسید فوق خالصی تضمین می کند که هیچ آلاینده ناخواسته ای در حین ساخت ویفر وارد فرآیند نشود. از طریق نقش های تمیزکاری و اچ کاری خود، اسید نیتریک امکان ساخت اجزای ریز و پیچیده ای را فراهم می کند که نیروی محرکه کامپیوترها، گوشی های هوشمند و سایر دستگاه های الکترونیکی امروزی هستند.
اسید نیتریک در کاربردهای آزمایشگاهی و تحلیلی
اسید نیتریک یک واکنشگر اصلی در آزمایشگاه های شیمی و شیمی تجزیه است. قدرت اکسیدکنندگی بالای آن برای هضم یا حل کردن نمونه ها به منظور آنالیز مورد استفاده قرار می گیرد. به عنوان مثال، در آزمایشگاه های علوم محیطی و زمین شناسی، از اسید نیتریک برای تجزیه نمونه های خاک، لجن یا سنگ استفاده می شود تا برای تعیین فلزات کمیاب با تکنیک هایی مانند طیف سنجی جذب اتمی (AAS) یا پلاسمای جفت شده القایی (ICP) آماده شوند. با تجزیه مواد آلی و معدنی پیچیده، اسید نیتریک عناصر را به صورت محلول آزاد می کند تا بتوان مقادیر آن ها را به طور دقیق اندازه گیری کرد. به طور مشابه، در زیست شیمی این اسید به هضم نمونه های بافتی برای تحلیل مواد مغذی یا سموم کمک می کند. اسید نیتریک همچنین معمولاً برای تمیز کردن ظروف و تجهیزات آزمایشگاهی استفاده می شود آزمایشگاه ها اغلب ابزارها را در اسید نیتریک رقیق خیس می کنند تا هر گونه فلز باقیمانده یا آلاینده آلی را برطرف سازند و اطمینان حاصل کنند که آزمایش ها از وجود ناخالصی متاثر نشوند. اسید نیتریک در برخی کیت های آزمایش شیمیایی نیز به دلیل توانایی آن در ایجاد واکنش های متمایز با برخی مواد ظاهر می شود. در نمایش های آموزشی، اسید نیتریک اصول شیمیایی را به صورت زنده به نمایش می گذارد: افزودن اسید نیتریک به فلز مس یک گاز قهوه ای (دی اکسید نیتروژن) و یک محلول سبز رنگ نیترات مس تولید می کند که واکنش های اکسایش-کاهش را به طور دراماتیک نشان می دهد. چه در آماده سازی نمونه، چه در تمیز کردن ابزار و چه در آموزش، اهمیت اسید نیتریک در محیط آزمایشگاهی غیرقابل انکار است.
اسید نیتریک در نانوفناوری و مواد پیشرفته
با ورود علم به مقیاس نانو، اسید نیتریک همچنان ابزاری ارزشمند برای اصلاح و بهبود مواد پیشرفته است. در فناوری نانوکربن، از تیمارهای اسیدی قوی به طور معمول برای خالص سازی و عامل دار کردن موادی مانند نانولوله های کربنی (CNT) استفاده می شود. نمونه های خام نانولوله اغلب حاوی ذرات کاتالیزگر فلزی و ناخالصی های کربنی حاصل از سنتز خود هستند. با انجام رفلاکس یا تیمار آن ها با اسید نیتریک (اغلب به همراه اسید سولفوریک)، تولیدکنندگان می توانند آن ناخالصی ها را به صورت اکسیداتیو حذف کنند. این فرایند نه تنها نانولوله ها را تمیز می کند بلکه گروه های عاملی حاوی اکسیژن (مانند گروه های کربوکسیلیک) را نیز به ساختار کربنی آن ها متصل می کند که پراکندگی آن ها در حلال ها و سازگاری شان با مواد دیگر را بهبود می بخشد. علاوه بر این، اسید نیتریک به عنوان عامل دوپینگ برای نانومواد رسانا عمل می کند: برای مثال تماس شبکه های نانولوله کربنی یا گرافن با اسید نیتریک می تواند رسانایی الکتریکی آن ها را با ایجاد دوپینگ انتقال بار (که در آن گروه های نیترات الکترون ها را از ساختار خارج می کنند و شبکه را رساناتر می سازند) افزایش دهد. این کاربردها نشان می دهند که حتی در مرز دانش مواد، ماده شیمیایی سنتی ای مانند اسید نیتریک نقشی تسهیل کننده دارد چه در پالایش خلوص مواد نانویی و چه در تنظیم خواص الکترونیکی آن ها برای کاربردهای پیشرفته.
اسید نیتریک در بازیافت سوخت هسته ای
صنعت هسته ای برای بازیافت مواد ارزشمند از سوخت مصرف شده راکتورها به اسید نیتریک متکی است. در فرایندهایی مانند PUREX (استخراج احیاکننده پلوتونیوم-اورانیوم)، میله های سوخت مصرف شده ابتدا به قطعاتی خرد و سپس در اسید نیتریک داغ و غلیظ حل می شوند. این مرحله خشن، ترکیب جامد اکسیدهای اورانیوم و سایر اکتینیدها را به محلولی از نیترات ها تبدیل می کند. اورانیوم، پلوتونیوم و سایر محصولات شکافت همگی وارد محلول اسید نیتریک می شوند و سپس می توان آن ها را به صورت شیمیایی توسط استخراج حلال از هم جدا کرد. در این روش، حلال آلی حاوی تری بوتیل فسفات به طور انتخابی اورانیوم و پلوتونیوم نیتراتی را از فاز اسیدی اسید نیتریک استخراج می کند و بیشتر محصولات شکافت ناخواسته را باقی می گذارد. مراحل بعدی اورانیوم و پلوتونیوم خالص را برای استفاده مجدد به عنوان سوخت راکتور برای مثال در سوخت ترکیبی MOX بازیابی می کنند، در حالی که پسماند سطح بالای باقی مانده برای دفع متمرکز می شود. اسید نیتریک برای این مرحله حل سازی اولیه ایده آل است، زیرا اکسیدهای فلزی را به طور موثر حل می کند و در عین حال با شیمی استخراج بعدی سازگار است. تجهیزات موجود در کارخانه های بازفرآوری معمولاً از فولاد زنگ نزن یا آلیاژهای ویژه ساخته می شوند تا در برابر خورندگی اسید نیتریک تحت شرایط پرتوزا مقاوم باشند. با استفاده از بازیافت مبتنی بر اسید نیتریک، برنامه های هسته ای می توانند پسماند را کاهش داده و استفاده موثرتری از منابع سوخت خود داشته باشند.
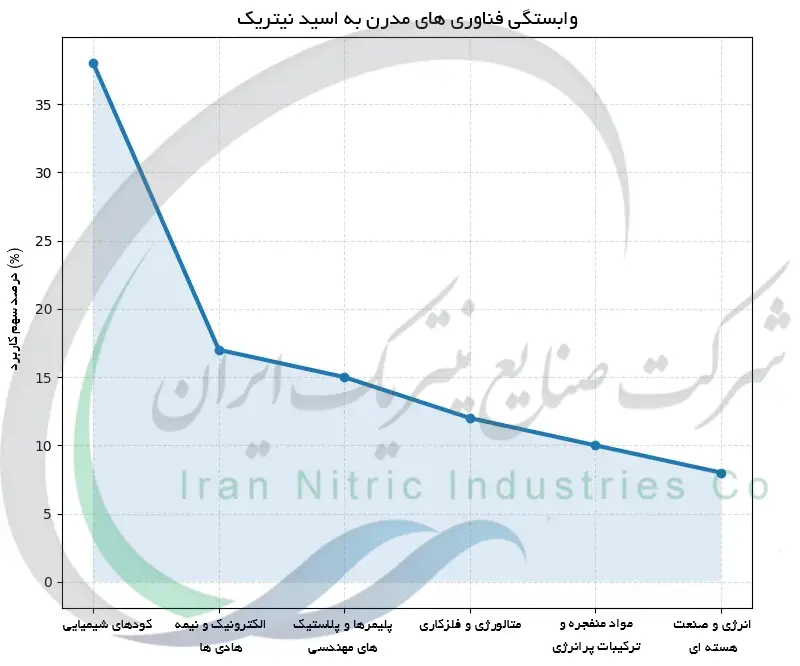
کاربردهای کلیدی اسید نیتریک در یک نگاه
جدول زیر مروری بر بخش های کلیدی دارد که اسید نیتریک در آن ها استفاده می شود، همراه با شکل یا غلظت معمول مصرف آن، مزایایی که فراهم می کند و چالش ها یا ملاحظات مرتبط با کاربرد آن. این جمع بندی نشان می دهد که چگونه یک ماده واحد (HNO3) می تواند فرآیندهایی را از تولید غذا گرفته تا پروازهای فضایی به حرکت درآورد و همچنین برجسته می کند که در هر مورد چه مسائل ایمنی و عملی باید مدیریت شوند.
| صنعت / بخش | کاربرد کلیدی اسید نیتریک | شکل / غلظت معمول اسید | مزیت کاربرد | چالش / ملاحظات |
|---|---|---|---|---|
| کشاورزی (تولید کود) | تولید نیترات آمونیوم و سایر کودهای نیتراته | اسید گرید صنعتی (~50–65% HNO₃) | افزایش بازده محصول با تامین عناصر نیتروژن ضروری برای گیاهان | خطر سوءاستفاده از کود (انفجار) و رواناب نیترات به محیط زیست |
| معدنکاری و مواد منفجره | سنتز مواد منفجره (TNT، نیتروگلیسیرین و غیره) و عوامل انفجاری ANFO | اسید غلیظ یا دودکننده برای واکنش های نیتره کردن | امکان تولید مواد منفجره قدرتمند برای معدنکاری، تخریب سازه و کاربردهای دفاعی | به دلیل خطرات انفجاری، نیازمند کنترل های ایمنی بسیار سخت گیرانه است |
| هوافضا (موشک) | اکسیدکننده پیشرانه مایع موشک (مانند RFNA در سوخت موشک ها و ماهواره برها) | اسید نیتریک دودکننده قرمز (بیش از 90 درصد HNO₃، مهار شده) | اکسیدکننده خوداشتعال و قابل ذخیره برای احتراق مطمئن و نگهداری بلندمدت | بسیار خورنده و سمی است و پیشرانه های جدیدتر تا حد زیادی جایگزین آن شده اند |
| پلیمر و پلاستیک | تولید پیش ماده های نایلون (اسید آدیپیک) و پلیمرهای نیتراته (نیتروسلولز) | اسید غلیظ (~50–70% HNO₃) در فرایندهای اکسیداسیون و نیتره کردن | امکان تولید پلاستیک ها و الیاف اصلی مانند نایلون و اجزای پلی یورتان | انتشار اکسید نیتروس به عنوان محصول جانبی و خورندگی فرایند |
| متالورژی و فلزکاری | اسیدشویی، تمیزکاری و پسیو کردن فلزات مانند فولاد زنگ نزن | اسید با غلظت متوسط (20–40% HNO₃) در آب یا محلول های مخلوط | حذف زنگار و تشکیل لایه اکسید محافظ و افزایش دوام فلز | تولید پسماند اسیدی و نیاز به خنثی سازی و تجهیزات ایمنی |
| تولید محصولات الکترونیکی | تمیزکاری و اچ کردن ویفر و برد مدار چاپی در ساخت نیمه هادی | اسید فوق خالص گرید الکترونیک (معمولاً 60–70% HNO₃) | حذف آلودگی های میکروسکوپی و تضمین عملکرد بالای قطعات الکترونیکی | لزوم خلوص بسیار بالا و مدیریت دقیق پسماند اسیدی |
| تحقیق و توسعه نانوفناوری | خالص سازی و عامل دار کردن نانومواد مانند نانولوله های کربنی | مخلوط های اسید قوی شامل HNO₃ و H₂SO₄ در آزمایشگاه | حذف ناخالصی ها و بهبود خواص ماده مانند رسانایی | احتمال آسیب به نانومواد در صورت اچ کاری بیش از حد |
| صنعت هسته ای | بازفرآوری سوخت هسته ای مصرف شده و حل کردن اکسیدهای اورانیوم و پلوتونیوم | اسید داغ و غلیظ (حدود 6 تا 8 مولار HNO₃) | بازیابی مواد شکافت پذیر باارزش و کاهش حجم پسماند هسته ای | محیط بسیار خورنده و پرتوزا و نیازمند تجهیزات تخصصی |




